Elektrochemische Zelle
„Elektrochemische Zelle“ ist ein Oberbegriff für verschiedene Anordnungen, die entweder in der Elektrochemie verwendet werden oder die auf elektrochemischen Vorgängen beruhen.
Es gibt verschiedene Haupttypen elektrochemischer Zellen, die sich darin unterscheiden, ob sie im Betrieb Energie abgeben oder aufnehmen: Zellen, die eine elektrische Spannung erzeugen und einen elektrischen Strom liefern können, sind galvanische Zellen. Zellen, die durch einen Strom von außen betrieben werden, sind Elektrolysezellen. Akkumulatoren sind Zellen, die abwechselnd Strom liefern und dann wieder durch einen von außen angelegten Strom geladen werden.

- Galvanische Zellen sind elektrochemische Stromquellen, die durch chemische Reaktionen an den chemisch verschiedenen Elektroden nutzbare elektrische Energie liefern.
- Elektrolysezellen dienen der Gewinnung von verschiedenen Stoffen durch Anlegen einer Spannung, siehe Elektrolyse.
- eine Akkumulatorzelle dient wie die galvanische Zelle als Stromquelle; durch Energiezufuhr wird sie wieder geladen. Der Ladungsvorgang entspricht einer Elektrolyse.
- Forschungs- oder Analysenzellen der Elektroanalytik und der Elektrochemie können drei oder mehr Elektroden (Arbeitselektrode, Referenzelektrode, Gegenelektrode, u. U. noch Indikatorelektrode(n)) haben. Wenn wechselnde Betriebsmodi möglich sind, kann man solche Zellen nicht eindeutig als Elektrolysezelle oder als galvanische Zelle klassifizieren.
Eine elektrochemische Zelle enthält mindestens zwei Elektroden, die immer als Elektronenleiter fungieren, und mindestens einen Elektrolyten, d. h. einen Ionenleiter. Der Elektrolyt kann flüssig oder fest sein, oder es sind sowohl flüssiger als auch fester Elektrolyt vorhanden. Eine elektrochemische Zelle kann somit definiert werden als eine Anordnung aus zwei Elektroden, die über einen Elektrolyten leitend verbunden sind.
Beispiele für galvanische Zellen

Eine Primärzelle, umgangssprachlich zumeist „Batterie“ genannt, ist eine elektrochemische Zelle, genauso jede Brennstoffzelle. Knopfzellen sind besonders kleine Zellen. Solche im Handel erhältliche elektrochemischen Zellen haben ein geschlossenes Gehäuse, um den Austritt der Elektrolytflüssigkeiten zu verhindern. Sie kommen daher dem Idealbild einer „Zelle“ im Sinne einer umschlossenen Einheit näher als manche in der Forschung verwendete elektrochemischen Zellen, die auch offen sein können.
Beispiele für Elektrolysezellen
 Schemazeichnung einer Downs-Zelle zur Elektrolyse von Natriumchlorid
Schemazeichnung einer Downs-Zelle zur Elektrolyse von Natriumchlorid.svg.png.webp) Schema einer elektrochemischen Zelle zur Abscheidung von Kupfer
Schema einer elektrochemischen Zelle zur Abscheidung von Kupfer Eine Hull-Zelle, hier gezeigt mit einer Zinklösung.
Eine Hull-Zelle, hier gezeigt mit einer Zinklösung. Eine Haring-Blum-Zelle mit einem Kupferelektrolyten.
Eine Haring-Blum-Zelle mit einem Kupferelektrolyten.
Es gibt Elektrolysen, die zur Herstellung von Grundchemikalien dienen, wie z. B. die Elektrolyse von geschmolzenem Natriumchlorid, die zur Darstellung der Elemente Natrium und Chlor dient. Für diesen großtechnischen Prozess wurde die Downs-Zelle entwickelt. Dann gibt es die Elektrolysen der Galvanotechnik, die Gegenstände mit Metallüberzügen beschichten. Dafür verwendet man Metallsalzlösungen wie das in der Abbildung schematisch gezeigte Kupfersalzbad mit Kupfersulfat CuSO4. Zum Testen und zum Optimieren der Abscheidungsbedingungen in der Galvanik dient die Hull-Zelle. Die Elektroden der Hull-Zelle sind nicht parallel zueinander. Dadurch ergibt sich an der Seite, an der die Elektroden näher beieinander stehen, höhere Stromdichten. So kann an einer Elektrode der Einfluss unterschiedlicher Stromdichten beobachtet werden, so dass die besten Elektrolysebedingungen bestimmt werden können. Auch die Haring-Blum-Zelle ist eine Testzelle der Galvanik, wobei mit Hilfe zweier gleicher Elektroden in unterschiedlichen Abständen die Makrostreufähigkeit untersucht wird.
Beispiele von Zellen für die Grundlagenforschung
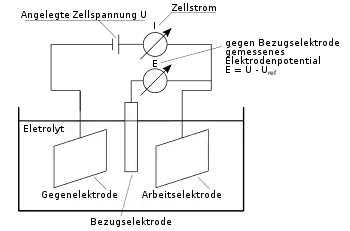
In der elektrochemischen Grundlagenforschung verwendet man zumeist eine Dreielektrodenmessanordnung, da sich damit das Potential eine Elektrode, der Arbeitselektrode, unabhängig vom Zustand der Gegenelektrode einstellen lässt. Zum Betrieb einer Dreielektrodenzelle benötigt man einen geeigneten Potentiostaten oder Galvanostaten und eine Bezugselektrode: Diese Geräte messen die Spannung zwischen Arbeits- und Bezugselektrode, wobei Ströme zwischen Arbeits- und Gegenelektrode fließen.
Ein spezieller Zelltyp der Forschung verwendet eine rotierende Elektrode, typischerweise eine Scheibenelektrode am Ende eines Stabes (rotating disk electrode RDE). Dieser wird mit Hilfe eines Elektromotors um die Stabachse rotiert, wobei die Rotationsgeschwindigkeit variabel und bekannt ist. Dabei stellt sich im flüssigen Elektrolyten ein bekanntes Strömungsprofil ein, und man kann den Einfluss des Transports im Elektrolyten auf die Elektrodenreaktion studieren. Eine Variante davon ist die Ring-Scheibenelektrode (rotating ring disk electrode RRDE), bei der eine weitere, ringförmige Elektrode um die Scheibenelektrode, ebenfalls konzentrisch zur Rotationsachse, befestigt ist.
Beispiel für elektrochemische Sensoren
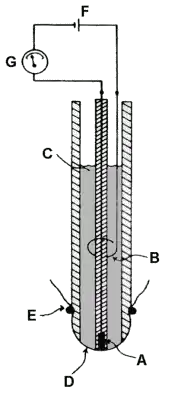 Schema einer Clark-Elektrode
Schema einer Clark-Elektrode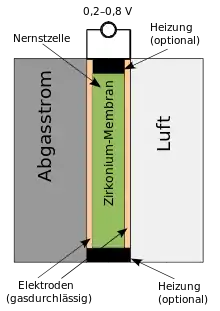 Planare Nernstzelle/ Lambdasonde, schematisch
Planare Nernstzelle/ Lambdasonde, schematisch
Eine Clark-Zelle ist ein elektrochemischer Sensor zur Bestimmung der Sauerstoffkonzentration in einer Lösung oder auch in Gasen. Im gezeigten Schema einer solchen Clark-Elektrode ist (A) die Kathode, an der der Sauerstoff reduziert wird. Sie besteht oft aus Platin. (B) ist eine Ag/AgCl-Anode (C) der KCl-Elektrolyt und (D) eine Teflon-Membran, die für den zu messenden Sauerstoff durchlässig ist, die aber ansonsten störende Umgebungseinflüsse von der Messzelle fernhält. (E) ist ein Gummiring und (F) eine zum Betrieb der Zelle benutzte Spannungsquelle. Der mit Hilfe des empfindlichen Stommessgerätes (G) gemessene Strom ist der Sauerstoffkonzentration proportional.
Auch die Nernstsonde ist eine elektrochemische Zelle als Sauerstoffsensor. Sie kann als Lambdasonde zur Motorsteuerung von Verbrennungsmotoren genutzt werden, wobei sie den Restsauerstoffgehalt im Abgas bestimmt.
Grundlegende Eigenschaften
Wichtige Eigenschaften einer elektrochemischen Zelle sind ihre momentane Spannung (Betriebsspannung) und bei technischen Zellen ihre Nennspannung, sowie die Ruhespannung, die die Zelle einnimmt, wenn kein Strom fließt. Aufgrund des Innenwiderstandes der Zelle und des dadurch verursachten Spannungsabfalls liegt die Betriebsspannung einer galvanischen Zelle (einer Batterie) unterhalb der Ruhespannung. Bei einer Elektrolysezelle hingegen, wo der Stromfluss von außen erzwungen wird, liegt die Betriebsspannung immer oberhalb der Ruhespannung. Die reversible Zellspannung ist die Ruhespannung im Gleichgewichtszustand.