Dimethylglyoxim
Dimethylglyoxim, auch Diacetyldioxim, ist ein Dioxim und wird als Nachweisreagenz (Tschugajew-Reagenz) für verschiedene Schwermetallionen verwendet.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
-biacetyl_dioxime_200.svg.png.webp) | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Dimethylglyoxim | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4H8N2O2 | |||||||||||||||
| Kurzbeschreibung |
farbloses, geruchloses Pulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 116,12 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
wenig löslich in Wasser (0,6 g·l−1 bei 20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−199,7 kJ/mol[4] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Geschichte
Der Komplexbildner wurde erstmals 1905 von Lew Alexandrowitsch Tschugajew beschrieben.[5]
Gewinnung und Darstellung
Dimethylglyoxim wird in einer mehrstufigen Reaktion gewonnen. Butanon (Methylethylketon) wird durch Nitrosierung mit Ethylnitrit in das Diacetylmonoxim überführt. Ohne vorherige Isolierung reagiert dieses mit Natrium-hydroxylamin-O-sulfonat zu Dimethylglyoxim.[6]
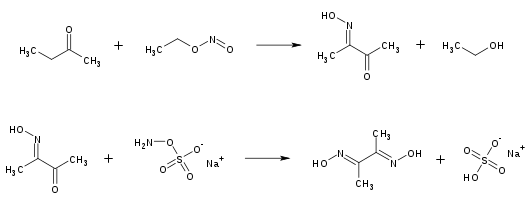
Syntheseverlauf von Dimethyldioxim, ausgehend von Butanon und Ethylnitrit.
Eigenschaften
Dimethylglyoxim ist ein Komplexbildner, der mit Schwermetallionen wie Ni2+, Fe2+, Co2+, Cu2+, Pt2+, Pd2+ und Re7+ farbige Chelatkomplexe bildet. Als qualitativer Nachweis lassen sich die Komplexe unter den jeweils geeigneten Bedingungen (pH und Temperatur) fällen. Komplexe von Co, Fe, Ni, Pd und Re sind zur quantitativen, photometrischen Bestimmung geeignet.[1]
Die Komplexe haben folgende Färbungen:[7]
- Nickel(II)-Komplex: himbeerrot
- Kupfer(II)-Komplex: violett
- Eisen(II)-Komplex: rot
- Cobalt(II)-Komplex: braunrot
- Palladium(II)-Komplex: gelb-gelblich
- Platin(II)-Komplex: braun und blau
- Blei(II)-Komplex: weiß
- Bismut(III)-Komplex: intensiv gelb[8]
Die mittels DSC bestimmte Zersetzungswärme beträgt −230 kJ·mol−1 bzw. −1980 kJ·kg−1.[9]
Nickelkomplex

Besonders das rosarote[10] bis himbeerrote,[11] sehr schwer lösliche Bis(dimethylglyoximato)nickel(II) (Nickel-Dimethylglyoxim-Komplex; [Ni(dmg)2]) in ammoniakalischer Lösung dient als qualitativer Nickel(II)-Nachweis (siehe auch Nickeltest) und wird zur quantitativen Bestimmung, sowohl über fotometrische, als auch gravimetrische Methoden für Nickelsalze genutzt. Die Chelatverbindung ist quadratisch-planar gebaut.[11]
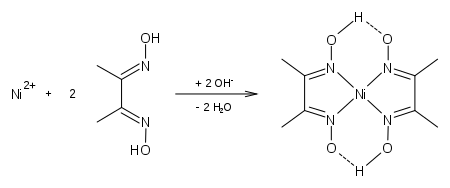
Die N-Ni-Bindungen sind somit koordinativer Natur.
Die Färbung kann noch bei 0,015 µg Nickel / ml nachgewiesen werden. (Grenzkonzentration von 1 : 4·105)[8]
Im Festzustand formen sich die Komplexe zu Molekülstapeln, dessen Ni–Ni-Abstände jeweils 325 pm betragen.[12]
Reagenz
- 1%ige alkoholische Lösung von Dimethyldioxim[8]
Einzelnachweise
- Eintrag zu Biacetyldioxim. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. Juni 2014.
- Eintrag zu Butandiondioxim in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- Eintrag zu Dimethylglyoxime in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-26.
- Lev Tschugaeff: Über ein neues, empfindliches Reagens auf Nickel. In: Berichte der deutschen chemischen Gesellschaft. 1905, Bd. 38, Nr. 3, S. 2520-2522, doi:10.1002/cber.19050380317.
- K. H. Slotta, K. R. Jacobi: Herstellung organischer Reagenzien im analytischen Laboratorium. III. Diacetyldioxim. In: Zeitschrift für Analytische Chemie. Band 83, Nr. 1-2, Januar 1931, S. 1–5, doi:10.1007/bf01361818.
- Gerhard Jander: Jander⋅Blasius Lehrbuch der analytischen und präparativen anorganischen Chemie, Hirzel, Stuttgart, 1985, S. 259, 359, 361.
- G. Jander, H. Wendt: Lehrbuch der analytischen und präparativen anorganischen Chemie. 2. Auflage. S. Hirzel Verlag, Leipzig 1954, S. 108 f., 191.
- Grewer, T.; Klais, O.: Exotherme Zersetzung - Untersuchungen der charakteristischen Stoffeigenschaften,VDI-Verlag, Schriftenreihe "Humanisierung des Arbeitslebens", Band 84, Düsseldorf 1988, ISBN 3-18-400855-X, S. 9.
- Wittko Francke und Wolfgang Walter: Lehrbuch der Organischen Chemie. S. Hirzel Verlag Stuttgart; 24. überarb. Auflage 2004, ISBN 3-7776-1221-9; S. 342.
- Wolfgang Werner: Qualitative anorganische Analyse: für Pharmazeuten und Naturwissenschaftler Deutscher Apotheker Verlag; 4. völlig neu bearb. u. erw. Auflage 2006; ISBN 3-8047-2264-4; S. 95.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1715.
