Diisopropylnaphthaline
Diisopropylnaphthaline (DIPN) sind chemische Verbindungen aus der Gruppe der Naphthaline. Zu ihnen gehören die Isomere 1,2-, 1,3-, 1,4-, 1,5-, 1,6-, 1,7-, 1,8-, 2,3-, 2,6- und 2,7-Diisopropylnaphthalin. Im technischen Produkt, das ein Isomerengemisch darstellt, sind hauptsächlich 1,3-, 1,4-, 1,5-, 1,6-, 1,7-, 2,6- und 2,7-Diisopropylnaphthalin enthalten, wobei 2,6- und 2,7-Diisopropylnaphthalin als bevorzugte Isomere mit je etwa 40 % den Hauptteil ausmachen.[1]
Gewinnung und Darstellung
Diisopropylnaphthalingemische werden hauptsächlich aus Naphthalin oder Monoisopropylnaphthalin durch Alkylierungs- oder Umalkylierungsreaktionen hergestellt.[1] Bei einer Herstellvariante wird Naphthalin mit Propen in einem Festbettreaktor über einem Alumosilikatkatalysator bei Temperaturen zwischen 160 °C und 250 °C umgesetzt.[2] Die Zusammensetzung der resultierenden Isomerengemische kann durch die Temperatur beeinflusst werden. Eine Trennung der Isomere kann durch eine Kombination von Destillations- und Kristallisationsschritten erfolgen.[2]
Eigenschaften
Diisopropylnaphthalin als technisches Produkt ist eine farb- und geruchlose Flüssigkeit.[3] 1,3- und 2,6-Diisopropylnaphthalin sind farblose Feststoff.[2][4]
| Diisopropylnaphthaline | ||||||||||||
| Name | 1,2- | 1,3- | 1,4- | 1,5- | 1,6- | 1,7- | 1,8- | 2,3- | 2,6- | 2,7- | ||
| Andere Namen |
| |||||||||||
| Strukturformel | 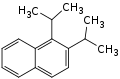 |
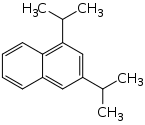 |
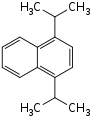 |
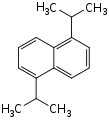 |
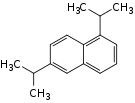 |
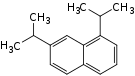 |
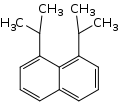 |
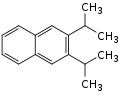 |
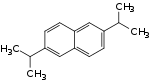 |
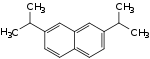 | ||
| CAS-Nummer | 94133-79-6 | 57122-16-4 | 24157-79-7 | 27351-96-8 | 51113-41-8 | 94133-80-9 | 24192-58-3 | 94133-81-0 | 24157-81-1 | 40458-98-8 | ||
| 38640-62-9 (Isomerengemisch) | ||||||||||||
| PubChem | 92672 | 117971 | 3023652 | 90390 | 32241 | 94505 | ||||||
| Summenformel | C16H20 | |||||||||||
| Molare Masse | 212,33 g·mol−1 | |||||||||||
| Aggregatzustand | flüssig | fest | flüssig | fest[5] | flüssig | |||||||
| Kurzbeschreibung | farb- und geruchlose Flüssigkeit (Isomerengemisch)[3] | |||||||||||
| Schmelzpunkt | 46,2 °C[2] | 68,5 °C[2]; 70 °C[4][6] | ||||||||||
| <−40 °C (Isomerengemisch)[6] | ||||||||||||
| Siedepunkt | 90 °C (0,8 Torr)[7] | 309 °C[8][9] | 315 °C[8][9] 293 °C[10] | 311 °C[8][9] | 318 °C[8][9] | 309 °C[8][9] | 318 °C[8][9] 290–300 °C[3] | 319 °C[8][9] 279,3 °C[5] | 317 °C[8][9] 280 °C[11] | |||
| 290–299 °C (Isomerengemisch)[6] | ||||||||||||
| Dichte | 1,0073[12] | 0,965[13] | ||||||||||
| 0,96 g·cm−3 (Isomerengemisch)[6] | ||||||||||||
| Löslichkeit | praktisch unlöslich in Wasser (0,11 mg·l−1 bei 25 °C)[14] | |||||||||||
| Brechungsindex | 1,564[7] | 1,5782 (20 °C)[15] | 1,565 (25 °C)[14] | 1,5701[16] | ||||||||
| 1,565 (Isomerengemisch)[6] | ||||||||||||
| Wärmekapazität | 1,71 kJ·kg−1·K−1 (Isomerengemisch bei 20 °C)[6] | |||||||||||
| Wärmeleitfähigkeit | 0,12 W·m−1·K−1 (Isomerengemisch bei 20 °C)[6] | |||||||||||
| Flammpunkt | >130 °C (Isomerengemisch)[6] | |||||||||||
| GHS- Kennzeichnung[3] |
| |||||||||||
| H- und P-Sätze | keine H-Sätze | |||||||||||
| keine EUH-Sätze | ||||||||||||
| keine P-Sätze | ||||||||||||
| Toxikologische Daten | > 3900 mg·kg−1 (LD50, Ratte, oral)[3] | |||||||||||
Verwendung
Diisopropylnaphthalin wird als Ersatzstoff für polychlorierte Biphenyle und als Lösungsmittel für Farbstoffe in Selbstdurchschreibepapieren eingesetzt. Allein in Japan und Deutschland werden jährlich jeweils 10.000 Tonnen des DIPN-Isomerengemisches hergestellt.[17] Das DIPN bereitet Probleme beim Recycling von Altpapier, wenn dieses anschließend als Verpackungsmaterial im Lebensmittelbereich eingesetzt wird, da es beim Recyclingprozess nicht entfernt wird und beim Fehlen einer zusätzlichen Umverpackung auf die Lebensmittel übergehen kann. Zurzeit (Stand 2001) sind zwar keine konkreten gesundheitlichen Bedenken zu DIPN bekannt, jedoch sollte laut Ansicht des Bundesinstitutes für gesundheitlichen Verbraucherschutz und Veterinärmedizin im Sinne des allgemeinen Minimierungsgebotes der Gehalt von DIPN so gering wie technisch möglich gehalten werden.[18] Toxikologisch sind die DIPN laut einer Untersuchung des Bundesinstitut für Risikobewertung (Stand 2011) unbedenklich, da die Alkylsubstitution des aromatischen Rings eine Ringoxidation und damit die Umwandlung zu toxischen Reaktionsprodukten verhindert.[19] 2,6-DIPN ist funktionell und strukturell identisch mit natürlich vorkommenden Pflanzenwachstumsregulatoren in Kartoffeln und wird deshalb auch als Keimstoppmittel für Kartoffeln eingesetzt.[20]
Literatur
- Gabriele Haack: Untersuchungen zu Wechselwirkungen zwischen Lebensmittelverpackungen auf Kartonbasis mit deren Füllgütern: Bestimmung und Abschätzung von Verteilungskoeffizienten zwischen Kartons und Lebensmittel(simulantien). München 2006, DNB 985511753, urn:nbn:de:bvb:91-diss20070104-2128347919 (Dissertation, TU München).
Einzelnachweise
- Robert Brzozowski, Jan Cz. Dobrowolski, Michał H. Jamróz, Wincenty Skupinski: Studies on diisopropylnaphthalene substitutional isomerism. In: Journal of Molecular Catalysis A: Chemical. Band 170, Nr. 1, Mai 2001, S. 95–99, doi:10.1016/S1381-1169(00)00427-1.
- Brzozowski, R.; Skupiński, W.; Jamróz, W.H.; Skarżyński, M.; Otwinowska, H.: Isolation and identification of diisopropylnaphthalene isomers in the alkylation products of naphthalene in J. Chromatogr. A 946 (2002) 221-227, doi:10.1016/S0021-9673(01)01571-0.
- IUCLID Datasheet: bis(isopropyl)naphthalene (Memento vom 2. Januar 2014 im Internet Archive) vom 18. Februar 2000.
- Eintrag zu 2,6-Diisopropylnaphthalene bei TCI Europe, abgerufen am 10. Januar 2012.
- Eintrag zu 2,6-Diisopropylnaphthalin bei ChemicalBook, abgerufen am 9. Januar 2012.
- Collin, G.; Höke, H.; Greim, H.: Naphthalene and Hydronaphthalenes in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2012, doi:10.1002/14356007.a17_001.pub2.
- Braude, E.A.; Jackman, L.M.; Linstead, R.P.; Lowe, G.: Hydrogen transfer. Part XII. Dehydrogenation of “blocked” hydroaromatic compounds by quinones in J. Chem. Soc., 1960, S. 3123–3132, doi:10.1039/JR9600003123.
- Bouviera, C.; Reumkens, N.; Buijs, W.: Separation of diisopropylnaphthalene isomers in J. Chromatogr. A 1216 (2009) 6410-6416, doi:10.1016/j.chroma.2009.07.006.
- Patent US4950824: Reacting monoisopropylnaphthalene with propylene and transalkylation of mixture formed. Angemeldet am 2. August 1989, veröffentlicht am 21. August 1990, Anmelder: Chiyoda Corporation, NKK Corporation, Erfinder: Yoshimi Shiroto et al..
- Egorow et al.: Zhurnal Fizicheskoi Khimii 34 (1960) 888,889,(engl. Ausgabe) p. 422.
- Eintrag zu 2,7-Diisopropylnaphthalin bei ChemicalBook, abgerufen am 9. Januar 2012.
- Hueckel, W.; Cramer, R.; Läufer, S.: Reduktionen in flüssigem Ammoniak, XIII Reduktion und reduzierende Methylierung von 2-Methyl- und 1.2.3-Trimethyl-naphthalin; Isopropylierung des Naphthalins in: Liebigs Ann. Chem., 1960, 630, S. 89–104, doi:10.1002/jlac.19606300112.
- Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons. William Andrew, 2014, ISBN 978-0-323-29060-9, S. 332 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu Diisopropylnaphthalene in der Hazardous Substances Data Bank, abgerufen am 27. Juli 2012 (online auf PubChem).
- Walter Hückel, Rolf Cramer, Siegmar Läufer: Reduktionen in flüssigem Ammoniak, XIII Reduktion und reduzierende Methylierung von 2-Methyl- und 1.2.3-Trimethyl-naphthalin; Isopropylierung des Naphthalins. In: Justus Liebigs Annalen der Chemie. Band 630, Nr. 1, 17. Mai 1960, S. 89–104, doi:10.1002/jlac.19606300112.
- Zukerwanik, Terentjewa; in: Chem. Zentralblatt, 1938, 109, S. 579.
- [https://de.wikipedia.org/w/index.php?title=Wikipedia:Defekte_Weblinks&dwl=http://www.labor-friedle.de/files/upload/DIPN.pdf Seite nicht mehr abrufbar], Suche in Webarchiven: [http://timetravel.mementoweb.org/list/2010/http://www.labor-friedle.de/files/upload/DIPN.pdf Aktuelles Thema: Diisopropylnaphthalin (DIPN)] (PDF; 382 kB), abgerufen am 5. Januar 2012.
- BFR: Bericht über die 109. Sitzung der Kommission/Expertengruppe für die gesund-heitliche Beurteilung von Kunststoffen und anderen Materialien im Rahmen des Lebensmittel- und Bedarfsgegenständegesetzes des Bundesinstitutes für gesundheitlichen Verbraucherschutz und Veterinärmedizin (Kunststoff-Kommission/Expertengruppe des BgVV) am 25./26. April 2001 in Berlin (PDF; 84 kB)
- Mineralölderivate aus Lebensmittelverpackungen – Aktueller Stand aus toxikologischer Sicht (PDF; 241 kB)
- EPA: 2,6-Diisopropylnaphthalene