Difluorbenzole
Die Difluorbenzole bilden in der Chemie eine Stoffgruppe, bestehend aus einem Benzolring mit zwei Fluoratomen (–F) als Substituenten. Durch deren unterschiedliche Anordnung (ortho, meta oder para) ergeben sich drei Konstitutionsisomere mit der Summenformel C6H4F2.
| Difluorbenzole | |||||||
| Name | 1,2-Difluorbenzol | 1,3-Difluorbenzol | 1,4-Difluorbenzol | ||||
| Andere Namen | o-Difluorbenzol | m-Difluorbenzol | p-Difluorbenzol | ||||
| Strukturformel | 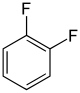 |
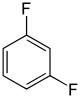 |
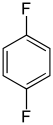 | ||||
| CAS-Nummer | 367-11-3 | 372-18-9 | 540-36-3 | ||||
| PubChem | 9706 | 9741 | 10892 | ||||
| Summenformel | C6H4F2 | ||||||
| Molare Masse | 114,10 g·mol−1 | ||||||
| Aggregatzustand | flüssig | ||||||
| Schmelzpunkt | −34 °C[1] | −59 °C[2] | −13 °C[3] | ||||
| Siedepunkt | 92 °C[1] | 82 °C[4] | 88–89 °C[3] | ||||
| Dichte | 1,158 g·cm−3 (25 °C)[1] | 1,163 g·cm−3 (25 °C)[4] | 1,11 g·cm−3 (25 °C)[3] | ||||
| GHS- Kennzeichnung |
|
|
| ||||
| H- und P-Sätze | 225 | 225‐332 | 225 | ||||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | |||||
| 210 | 210‐370+378‐403+235 | 210 | |||||
Eigenschaften
Die Siedepunkte der drei Isomere liegen relativ nah beieinander, während sich ihre Schmelzpunkte deutlicher unterscheiden. Das 1,4-Difluorbenzol, welches die höchste Symmetrie aufweist, besitzt den höchsten Schmelzpunkt.
Verwendung
1,2-Difluorbenzol wird als Lösungsmittel für die elektrochemische Analyse von Übergangsmetallkomplexen verwendet. Es ist chemisch ziemlich inert, nichtkoordinierend, und besitzt eine Dielektrizitätskonstante, die groß genug ist, um zahlreiche Elektrolyte und Metallkomplexsalze zu lösen. Es wird anstelle der gängigen Lösungsmittel wie Acetonitril, DMSO und DMF verwendet, weil diese koordinierende Eigenschaften haben.[5]
Literatur
- M. T. Kirchner, D. Bläser, R. Boese, T. S. Thakur, G. R. Desiraju: „1,3-Difluorobenzene“, in: Acta Cryst., 2009, E65, o2668–o2669; doi:10.1107/S1600536809038987.
- Heinrich Mäder: Komplexe von Wasser mit fluorierten Benzolen: Mikrowellenspektroskopische Untersuchungen zur Struktur und Dynamik. (PDF-Datei; 348 kB)
Einzelnachweise
- Datenblatt 1,2-Difluorbenzol bei Sigma-Aldrich, abgerufen am 13. März 2017 (PDF).
- Eintrag zu 1,3-Difluorbenzol bei ChemBlink, abgerufen am 13. März 2017.
- Datenblatt 1,4-Difluorbenzol bei Sigma-Aldrich, abgerufen am 13. März 2017 (PDF).
- Datenblatt 1,3-Difluorbenzol bei Sigma-Aldrich, abgerufen am 13. März 2017 (PDF).
- T. R. O’Toole, J. N. Younathan, B. P. Sullivan, T. J. Meyer: „1,2-Difluorobenzene: A Relatively Inert and Noncoordinating Solvent for Electrochemical Studies on Transition-Metal Complexes“, in: Inorg. Chem., 1989, 28 (20), S. 3923–3926; doi:10.1021/ic00319a032.

