Demjanow-Umlagerung
Die Demjanow-Umlagerung (auch als Demjanow-Reaktion bekannt) ist eine Namensreaktion der Organischen Chemie, die nach dem russischen Chemiker Nikolai Jakowlewitsch Demjanow (1861–1938) benannt wurde. Dabei handelt es sich um eine Substitutionsreaktion, wobei eine Amino- durch eine Hydroxygruppe ersetzt wird.
Übersichtsreaktion
Die Reaktion kann mit primären oder sekundären, cyclischen Aminen durchgeführt werden, wobei die Produkte verkleinerte oder vergrößerte, cyclische Verbindungen sein können. Dabei werden diese mit salpetriger Säure und Wasser umgesetzt. Bei der Verwendung sekundärer, cyclischer Amine erfolgt entweder die einfache Substitution (links oben) oder eine Verkleinerung des Rings zum primären Alkohol (links unten).[1]
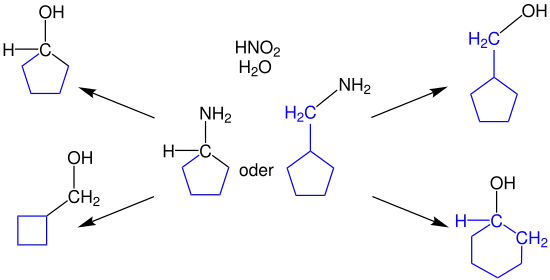
Wird ein primäres cyclisches Amin verwendet, kann ebenfalls eine Substitution der Aminogruppe durch eine Hydroxygruppe erfolgen (rechts oben). Bei einer Ringvergrößerung wird ein sekundärer Alkohol (rechts unten) als Produkt erhalten.
Reaktionsmechanismus
In allen genannten Reaktionen wird die salpetrige Säure durch Wasser protoniert. Unter Eliminierung eines Wassermoleküls aus dem entstandenen Oxoniumion entsteht ein Nitrosoniumion, welches über zwei mesomere Grenzstrukturen verfügt.

Im Folgenden werden die Reaktionen des Nitrosoniumions mit den genannten Edukten dargestellt. Dabei wird als erstes der grundsätzliche Mechanismus beschrieben, wobei die cyclische Struktur in gleicher Form erhalten bleibt, um anschließend die Änderung der cyclischen Strukturen zu erläutern.
Ringverkleinerung
Zuerst soll die Ringverkleinerung (linker Teil der Übersichtsreaktion) erläutert werden. Das sekundäre, cyclische Amin 1 wird mit dem Nitrosoniumion umgesetzt, wodurch das Kation 2 entsteht. Durch intramolekulare Protonierung der im Kation 3 entstandenen Hydroxygruppe und unter Eliminierung von Wasser entsteht das Diazoniumkation 4.
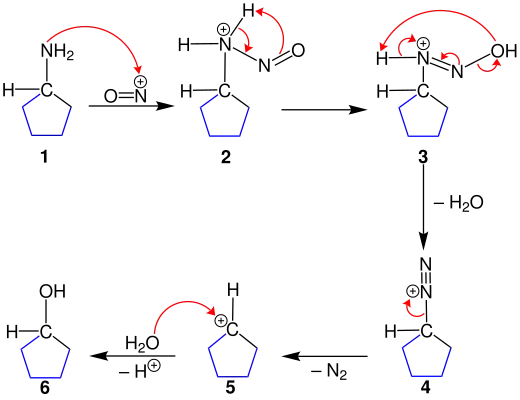
Die anschließende Eliminierung eines Stickstoffmoleküls ergibt die Bildung des Carbeniumions 5. Durch anschließende Hydrolyse wird der sekundäre Alkohol 6 erhalten. Die Anzahl der ringbildenden Kohlenstoffatome ist dabei erhalten geblieben. Die Ringverkleinerung folgt, bis zur Bildung des Carbeniumions 5, dem identischen Mechanismus. Dieses wird jedoch nicht mit Wasser behandelt, sondern unterliegt einer 1,2-Wasserstoff-Verschiebung. Dabei wird eine neue C-C-Bindung gebildet.
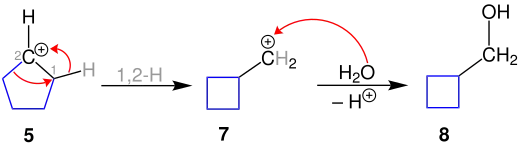
Das Zwischenprodukt ist das primäre Carbeniumion 7. Dabei ist die Ringverkleinerung vom Cyclopentan zum Cyclobutan erfolgt. Durch anschließende Aufarbeitung mit Wasser entsteht der primäre Alkohol 8.
Ringvergrößerung
Die Umsetzung eines primären Amins 9 folgt bis zur Bildung des Carbeniumions dem gleichen Mechanismus, welcher bei der Ringverkleinerung bereits beschrieben wurde. Darum wird dieser nicht erneut ausgeführt. Das entstehende Carbeniumion 10 unterscheidet sich nur leicht vom Carbeniumion 7. Das Carbeniumion 10 wird auch hier mit Wasser aufgearbeitet, um zum primären Alkohol 11 zu gelangen. Die fünfgliedrige, cyclische Struktur bleibt dabei gleich.
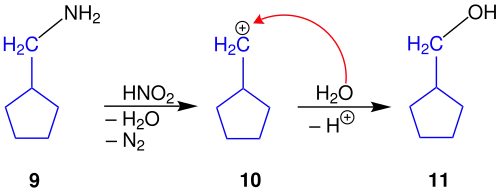
Auch die Ringerweiterung geht vom primären Carbeniumion 10 aus. Dieses lagert aus Stabilitätsgründen zum sekundären Carbeniumion 12 um.
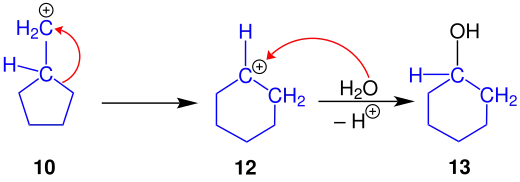
Die Aufarbeitung mit Wasser liefert den sekundären Alkohol 13.
Praktische Bedeutung
Die Demjanov-Umlagerung ist eine Methode, um Vier-, Fünf- oder Sechsringe um ein Kohlenstoffatom zu erweitern oder zu verkleinern. Die erhaltenen Produkte können in einer Reihe weiterer Reaktionen verwendet werden.[2][3]
Probleme
Bei beiden Reaktionen ist es schwer die entstandenen Produkte zu isolieren, was negative Auswirkungen auf die Ausbeute hat. Die Regioselektivität der Reaktion ist ebenfalls problematisch.[4][5]
Ähnliche Umlagerungsreaktionen
Literatur
- Z. Wang: Comprehensive Organic Name Reactions and Reagents, Vol 1. John Wiley & Sons, Hoboken, New Jersey 2009, S. 868–870, ISBN 978-0-471-70450-8.
- Jie Jack Li: Name reactions, a collection of detailed reaction mechanism. Vol 1.Springer 2002, S. 95. ISBN 3-540-43024-5.
Einzelnachweise
- J. Diamond, W.F. Bruce, F.T. Tyson: Hexahydro-1-methyl-4-phenyl-4-acetoxyazepine and the Demjanov Rearrangement of 1-Methyl-4-phenylpiperidine-4-methylamine*, The Journal of Organic Chemistry 1965, 30(6), 1840–1844, doi:10.1021/jo01017a030.
- R.Kotani: Demjanov Rearrangement of 1-Methylcyclohexanemethylamine, The Journal of Organic Chemistry 1965, 30(2), 350–354, doi:10.1021/jo01013a009.
- A.G. Stern, A. Nickon Synthesis of brexan-2-one and ring-expanded congeners, The Journal of Organic Chemistry 1992, 57(20), 5342–5352, doi:10.1021/jo00046a015.
- J.B. Jones, P. Price: Steroids and steroidases—XIX: Comparison of diazomethane and tiffeneau-demjanov homologations of 5α-3-oxosteroids. Evidence for predominant equatorial approach of the C-3 carbonyl group by diazomethane, Tetrahedron 1973, 29(14), 1941–1947, doi:10.1016/0040-4020(73)80128-0.
- M. Nakazaki, K. Naemura, M. Hashimoto: Unusual consecutive rearrangements in the Demjanov ring-expansion reaction of 2-(aminomethyl)-D2d-dinoradamantane and 9-(aminomethyl)noradamantane, The Journal of Organic Chemistry 1985, 48(13), 2289–2291, doi:10.1021/jo00161a033.