Tiffeneau-Ringerweiterung
Die Tiffeneau-Ringerweiterung (auch Tiffeneau-Demjanow-Reaktion, -Umlagerung oder -Ringerweiterung) ist eine Namensreaktion aus dem Bereich der Organischen Chemie und beschreibt die Synthese von ringerweiterten, cyclischen Ketonen ausgehend von 1-Aminomethylcycloalkoholen (β-Aminoalkohol).[1]
Übersichtsreaktion
Die Reaktion wurde in zwei Teilschritten entdeckt. 1901 beobachtete der russische Chemiker Nikolai Jakowlewitsch Demjanow (russisch: Николай Яковлевич Демьянов; 1861–1938), dass bei der Diazotierung von Aminomethylcycloalkanen cyclische Ketone unter Ringexpansion entstehen. Diese Reaktion wurde nach ihm als Demjanow-Umlagerung benannt. 1937 publizierten Marc Tiffeneau (1873–1945),[2] Weill und Tchoubar ihre Resultate zur Diazotierung von 1-Aminomethylcyclohexanol, wobei Cycloheptanon entsteht:[3]
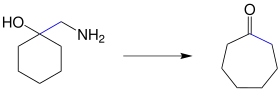
Die Tiffeneau-Demjanow-Reaktion gehört zur Gruppe der über Carbeniumionen verlaufenden Umlagerungen wie auch die Wagner-Meerwein-Umlagerung. Besondere Ähnlichkeit besteht wegen der 1,2-Verschiebung des Alkylrestes zur Pinakol-Umlagerung.[4]
Reaktionsmechanismus
Der Reaktionsmechanismus[5][6][7] soll am Beispiel von Cyclohexanon aus 1-Aminomethylcyclopentanol 1 und verdünnter Salpetriger Säure gezeigt werden. Hierzu wird im ersten Schritt das elektrophile Nitrosylkation 2 hergestellt[8], welches von dem freien Elektronenpaar des Stickstoffs in der Aminogruppe angegriffen wird. Nach Abschluss der Diazotierung liegt ein Diazonium-Kation 3 vor.

Da aliphatische Diazoniumsalze nicht resonanzstabilisiert sind und somit keine stabilen Verbindungen darstellen, neigen sie zum Zerfall und spalten schnell ein Stickstoffmolekül ab, wodurch ein primäres Carbeniumion 4 entsteht. Primäre Carbeniumionen sind sehr instabil und lagern sofort unter einer 1,2-Verschiebung des Alkylrestes um, die zu einer Ringerweiterung und der Entstehung eines mesomeriestabilisierten Carbeniumions 5 führt. Die Abspaltung von Stickstoff und die Umlagerung erfolgen konzertiert, daher ist der Mechanismus formal nicht SN1, sondern SNi. Die anschließende Deprotonierung führt zu Cyclohexanon (6).
Anwendung
Die Reaktion kann dazu genutzt werden, cyclische Ketone um eine Methylengruppe zu erweitern. Hierzu wird an die Carbonylgruppe des Ketons 1 beispielsweise Nitromethan oder Cyanwasserstoff angelagert und die entsprechenden Reaktionsprodukte (Nitromethylalkohol 2 bzw. Cyanhydrin 3) zum β-Aminoalkohol 4 hydriert.[9][10]

Die Umlagerung des β-Aminoalkohols durch die Tiffeneau-Demjanow-Reaktion ergibt dann das ringerweiterte Keton 5.
Einzelnachweise
- L. Kürti, B. Czakó: Strategic Applications of Named Reactions in Organic Synthesis – Background and Detailed Mechanisms. Elsevier Inc., 2005, ISBN 978-0-12-369483-6, S. 134–135.
- shp-asso.org
- Marc Tiffeneau, Paul Weill, Bianca Tchoubar: Isomérisation de l'oxyde de méthylène cyclohexane en hexahydrobenzaldéhyde et désamination de l'aminoalcool correspondant en cycloheptanone. In: Comptes Rendus. 205, 1937, S. 54–56.
- W. Uhl, A. Kyriatsoulis: Namen- und Schlagwortreaktionen in der organischen Chemie. Vieweg & Sohn, Braunschweig 1984, ISBN 3-528-03581-1, S. 150–151.
- L. Kürti, B. Czakó: Strategic Applications of Named Reactions in Organic Synthesis – Background and Detailed Mechanisms. Elsevier Inc., 2005, ISBN 978-0-12-369483-6, S. 134–135.
- L. Kürti, B. Czakó: Strategic Applications of Named Reactions in Organic Synthesis – Background and Detailed Mechanisms. Elsevier Inc., 2005, ISBN 978-0-12-369483-6, S. 134–135.
- R. Brückner: Reaktionsmechanismen: Organische Reaktionen, Stereochemie, Moderne Synthesemethoden. 3. Auflage. Elsevier, München 2004, ISBN 3-8274-1579-9, S. 605–607.
- Diazotierung
- Francis A. Carey, Richard J. Sundberg: Organische Chemie, 2. korr. Nachdruck, Wiley-VCH-Verlag, 2004. ISBN 3-527-29217-9.
- C. Ferri, G. Düsing, W. Lürken: Reaktionen der Organischen Chemie. Thieme, Stuttgart 1978, ISBN 3-13-487401-6, S. 422.