Decitabin
Decitabin (Handelsname: Dacogen®, Hersteller: Janssen-Cilag) ist ein synthetisches Nukleosid. Es besteht aus der β-D-Desoxyribose (Zucker) und einem substituierten Triazin. Es ist ein chemisches Analogon des Nukleosids Desoxycytidin. Es ist ein Zytostatikum, das als DNA-Methyltransferase-Inhibitor (demethylierende Substanz) wirkt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
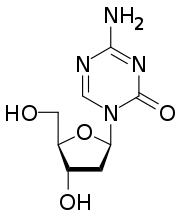 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Decitabin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C8H12N4O4 | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code |
L01BC | ||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Wirkmechanismus | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 228,21 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Eigenschaften
Das 5-Aza-2'-desoxycytidin unterscheidet sich chemisch vom Desoxycytidin, indem in der 5-Position eine C-H-Einheit formal durch ein Stickstoffatom ersetzt wird. Aus dem Pyrimidingrundgerüst wird somit ein 1,3,5-Triazingrundgerüst. Das Analogon mit Ribose ist das Azacitidin.
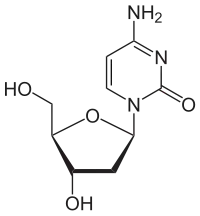 |
 |
 |
| Desoxycytidin, dC | Decitabin | 5-Azacytidin, 5-azaC |
Wirkung
Decitabin wurde 2006 durch die US-amerikanische FDA als orphan drug zur Therapie Myelodysplastischer Syndrome (MDS) zugelassen. Am 20. September 2012 erteilte die Europäische Kommission eine Zulassung für die gesamte EU zur Behandlung von Erwachsenen über 65 Jahren, die an akuter myeloischer Leukämie (AML) erkrankt sind.[3][4] Decitabin hat denselben Wirkmechanismus wie 5-Azacytidin. In einer bundesweiten klinischen Studie mit über 220 Patienten, die in den Jahren zwischen 2003 und 2009 durchgeführt wurde, wurde der Einsatz von niedrig dosiertem Decitabin für die Therapie von älteren AML-Patienten untersucht. Ziel einer weiteren Studie ist, wie Decitabin in der Kombination mit Valproinsäure beziehungsweise dem Vitamin-A-Präparat Retinsäure im Hinblick auf eine komplette oder zumindest teilweise Remission und auf das Überleben der Patienten wirkt.[5]
Frühe Nutzenbewertung
Seit 2011 müssen sich neu zugelassene Medikamente mit neuen Wirkstoffen aufgrund § 35a SGB V (AMNOG) einer „frühen Nutzenbewertung“ durch den Gemeinsamen Bundesausschuss (G-BA) unterziehen, wenn der pharmazeutische Hersteller einen höheren Verkaufspreis als nur den Festbetrag erzielen möchte. Nur wenn ein Zusatznutzen besteht, kann der Arzneimittelhersteller mit dem Spitzenverband der gesetzlichen Krankenkassen (GKV Spitzenverband) einen Preis aushandeln. Dies gilt auch für Decitabin. Eine erste Bewertung durch das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) ist im Vorfeld erfolgt.[6] Eine Beschlussfassung hinsichtlich des „Zusatznutzens“ von Decitabin durch den G-BA fand Ende April 2013 statt. Laut G-BA wurde ein geringer Zusatznutzen festgestellt.[7]
Weblinks
- Eintrag zu Decitabine in der Human Metabolome Database (HMDB), abgerufen am 15. November 2013.
- Label von Dacogen (PDF; 230 kB) FDA.
- Norbert Gattermann: Epigenetische Behandlung mit 5-Azacytidin und Decitabin. Deutsches MDS-Forum – Duisburg 2008.
- Zulassungs-Eintrag. In: Community Register of medicinal products der Europäischen Kommission
Einzelnachweise
- Datenblatt 5-Aza-2′-deoxycytidin bei Sigma-Aldrich, abgerufen am 2. November 2021 (PDF).
- Eintrag zu Decitabine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Zusammenfassung des EPAR für die Öffentlichkeit. (PDF; 77 kB) European Medicines Agency.
- Durchführungsbeschluss der Kommission vom 20.9.2012 über die Genehmigung für das Inverkehrbringen des Humanarzneimittels für seltene Leiden „Dacogen - Decitabine“ gemäß der Verordnung (EG) Nr. 726/2004 des Europäischen Parlaments und des Rates (PDF; 14,4 kB) Europäische Kommission.
- Benjamin Waschow: Hoffnung für ältere Patienten mit einer akuten myeloischen Leukämie. Universitätsklinikum Freiburg, Pressemitteilung vom 25. April 2012 beim Informationsdienst Wissenschaft (idw-online.de), abgerufen am 24. August 2015.
- Decitabin – Bewertung gemäß § 35a Abs. 1 Satz 10 SGB V (PDF; 120 kB) WebSite des IQWiG, 16. Januar 2013; abgerufen am 2. Mai 2013.
- G-BA trifft drei weitere Entscheidungen zu neuen Wirkstoffen. Pressemitteilung G-BA, 2. Mai 2013.