Cyanoacetylen
Cyanoacetylen ist eine organische Verbindung, die als monosubstituiertes Ethin bzw. als Nitril der Acetylencarbonsäure gesehen werden kann.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||||
| Name | Cyanoacetylen | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C3HN | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 51,05 g·mol−1 | |||||||||
| Aggregatzustand |
flüssig | |||||||||
| Dichte |
0,8167 g·cm−3 (17 °C)[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
44 °C[3] | |||||||||
| Löslichkeit |
leicht löslich in Toluol[4] | |||||||||
| Brechungsindex |
1,3868 (25 °C)[5] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||
Vorkommen
Cyanoacetylen wurde durch spektroskopische Methoden in interstellaren Wolken,[2] sowie im Schweif des Kometen Hale-Bopp und in der Atmosphäre des Saturnmondes Titan nachgewiesen.[7]
Darstellung und Gewinnung
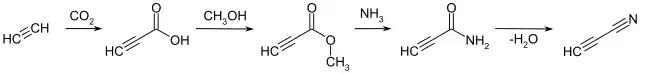
Die Darstellung von Cyanoacetylen gelingt durch die Dehydratisierung von Acetylencarbonsäureamid in Gegenwart von Phosphorpentoxid.[8][3] Das Säureamid kann über eine Esterstufe aus der Acetylencarbonsäure hergestellt werden,[2] die durch die Umsetzung von Ethin mit Kohlendioxid zugänglich ist.[9][10]
Eigenschaften
Cyanoacetylen ist eine niedrigsiedende, farblose Flüssigkeit.[2][3] Unterhalb von 5 °C erstarrt die Verbindung.[2] Festes Cyanoacetylen kristallisiert in einem monoklinen Kristallsystem.[11] Die Dämpfe sind leicht entzündlich und extrem tränenreizend.[2] Bei Bestrahlung mit UV-Licht polymerisiert Cyanoacetylen.[12] In Gegenwart von Peroxiden wird keine wesentliche radikalische Polymerisation beobachtet.[2] Mit Ammoniak wird über Wasserstoffbrücken ein 1:1-Komplex gebildet.[13] Cyanoacetylen besitzt eine merkliche CH-Acidität, d. h., es kann durch starke Basen deprotoniert werden. Grund ist die Mesomeriestabilisierung des Anions (−M-Effekt der Cyanogruppe).
Verwendung
Durch Ethoxycarbonylierung von Cyanoacetylen können Cyanoacrylate hergestellt werden.[14]
Einzelnachweise
- W. Dannhauser, A. F. Flueckinger: Dielectric Constant of Hydrogen‐Bonded Liquids. I. Cyanoacetylene. In: J. Chem. Phys. Band 38, 1963, S. 69–71, doi:10.1063/1.1733497.
- S. Murahashi, T. Takizawa, S. Kurioka, S. Maekawa: Cyanoacetylene. Part I.The synthesis and some chemical properties. In: Nippon kagaku zassi. Band 77, 1956, S. 1689–1692, doi:10.1246/nikkashi1948.77.1689, NASA TT F-11, 771 englische Übersetzung (PDF; 359 kB).
- R. J. Halter, R. L. Fimmen, R. J. McMahon, S. A. Peebles, R. L. Kuczkowski, J. F. Stanton: Microwave Spectra and Molecular Structures of (Z)-Pent-2-en-4-ynenitrile and Maleonitrile. In: J. Am. Chem. Soc. Band 123, 2001, S. 12353–12363, doi:10.1021/ja011195t.
- N. M. Szeverenyi, R. R. Vold, R. L. Vold: Mechanisms of nuclear magnetic relaxation in cyanoacetylene. In: Chem. Phys. Band 18, 1976, S. 23–30, doi:10.1016/0301-0104(76)87034-6
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-124.
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von prop-2-ynenitrile im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 19. Oktober 2021.
- H. B. Niemann u. a.: The abundances of constituents of Titan's atmosphere from the GCMS instrument on the Huygens probe. In: Nature. Band 438, 2005, S. 779–784, doi:10.1038/nature04122.
- U. Melamed, B.-A. Feit: Reaction of acrylonitrile with benzophenone via the derived vinyl carbanion. In: J. Org. Chem. Band 48, 1983, S. 1928–1931, doi:10.1021/jo00159a037.
- Skosarewski: In: Chem. Zentralbl. Band 75, 1904, S. 1025.
- G. Oddo: in Gazzetta Chimica Italiana. Band 38, 1908, S. 627–633.
- F. V. Shallcross, G. B. Carpender: The crystal structure of cyanoacetylene. In: Acta Cryst. Band 11, 1958, S. 490–496, doi:10.1107/S0365110X58001365.
- D. W. Clarke, J. P. Ferris: Titan Haze: Structure and Properties of Cyanoacetylene and Cyanoacetylene–Acetylene Photopolymers. In: Icarus. Band 127, 1997, S. 158–172, doi:10.1006/icar.1996.5667.
- N. Piétri, B. Sessouma, F. Borget, T. Chiavassa, I. Couturier-Tamburelli: Cyanoacetylene (HC3N) and ammonia (NH3) complexes: A DFT theoretical and experimental study. In: Chem. Phys. Band 400, 2012, S. 98–102, doi:10.1016/j.chemphys.2012.03.002.
- T. Ohara, T. Sato, N. Shimizu, G. Prescher, H. Schwind, O. Weiberg, K. Marten, H. Greim: Acrylic Acid and Derivatives. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag, Weinheim 2006, doi:10.1002/14356007.a01_161.pub2

