Cefapirin
Cefapirin ist ein Antibiotikum, welches bei Infektionen durch anfällige Bakterien verwendet wird. Es wird semisynthetisch hergestellt und gehört zur Klasse der Cephalosporine der 1. Generation.[3]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
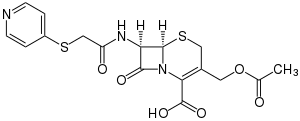 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Cefapirin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel |
| |||||||||||||||||||||
| Kurzbeschreibung |
gelblicher Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
J01DB08 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus |
Störung der Zellwandsynthese | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 423,46 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||||||||
| Schmelzpunkt |
>125 °C (Zersetzung)[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Cefapirin ist in Deutschland lediglich für die Verwendung bei Tieren zugelassen,[4] in der Humanmedizin wird es nicht verwendet.
Indikation
Cefapirin weist ein breites Wirkungsspektrum gegen grampositive und gramnegative Organismen auf. Cefapirin ist daher wie die meisten Cephalosporinen bei vielen Infektionen wie zum Beispiel einer Mittelohrentzündung oder Harnwegsinfektionen wirksam. Gegenüber Beta-Lactamasen ist Cefapirin resistenter als Penicilline. Es ist daher gegen Staphylokokken-Infektionen einsetzbar.[3][5]
In der Tiermedizin wird Cefapirin zur Behandlung von[6] oder Vorbeugung gegen Mastitis bei Kühen angewendet, ferner zur Behandlung der subakuten und chronischen Endometritis der Kuh.
Wirkungsprinzip
Die Cefapirin-Moleküle binden sich an spezifische Penicillin-bindende Proteine, welche sich in der bakteriellen Zellwand befinden. Dadurch wird die weitere Synthese der bakteriellen Zellwand gehindert.[3]
Applizierung
Cefapirin wird intramammär[7] (d. h. durch den Zitzenkanal in die Milchdrüse) oder intrauterin[8] verabreicht.
Chemisch-pharmazeutische Angaben
Pharmazeutisch eingesetzt werden das wasserlösliche[9] Cefapirin-Natrium[10] und das Cefapirin-Benzathin (2:1).[11]
Cefapirin sollte trocken und bei Raumtemperatur gelagert werden, so kann es 24 Monate lang verwendet werden. Eine rekonstituierte Lösung hält sich bei Raumtemperatur 12 Stunden und im Kühlschrank 10 Tage. Dabei können Farbveränderungen auftreten, welche jedoch nicht für einen Wirkungsverlust sprechen.[12]
Nebenwirkungen
Die häufigsten Nebenwirkungen sind Überempfindlichkeitsreaktionen und Veränderungen der Leberfunktion. Jedoch konnten auch Anzeichen von Störungen der weißen Blutkörperchen und Anämie festgestellt werden.[3]
Synthese
Die Synthese von Cefapirin geschieht über eine Semisynthese, welches in diesem Fall die Acylierung einer Aminogruppe bedeutet. Die zu acylierende 7-Aminocephalospransäure (kurz 7-ACA) wird dabei durch eine chemische Reaktion aus Penicillin G mithilfe von N,N′-Bis(trimethylsilyl)harnstoff umgewandelt. Das 7-ACA wird dann in einer enthydrochlorierenden Umgebung acyliert.[13][14]
Handelsnamen (Tiermedizin)
- Monopräparate
Masti-Safe (D), Metricure (D)
- Kombinationspräparate
mit Prednisolon: Mastiplan LC (D)
Einzelnachweise
- Eintrag zu Cephapirin bei Toronto Research Chemicals, abgerufen am 20. Januar 2022 (PDF).
- Datenblatt Cefapirin-Natrium bei Sigma-Aldrich, abgerufen am 21. Mai 2019 (PDF).
- Eintrag zu Cefapirin in der DrugBank der University of Alberta, abgerufen am 22. Mai 2019.
- Metricure wieder verfügbar. In: topagrar online. 9. Juli 2018, abgerufen am 20. Mai 2019.
- Gunter Schmidt: Cephalosporine. In: Chemie in unserer Zeit. Band 10, Nr. 6, 1976, S. 189–195, doi:10.1002/ciuz.19760100605.
- R. M. Stockler, D. E. Morin, R. K. Lantz, W. L. Hurley, P. D. Constable: Effect of milk fraction on concentrations of cephapirin and desacetylcephapirin in bovine milk after intramammary infusion of cephapirin sodium. In: Journal of Veterinary Pharmacology and Therapeutics. Band 32, Nr. 4, 2009, S. 345–352, doi:10.1111/j.1365-2885.2008.01048.x.
- Intervet Deutschland GmbH: Fachinformation Mastisafe. Stand März 2016.
- Intervet Deutschland GmbH: Fachinformation Metricure. Stand November 2012.
- Europäische Arzneibuch-Kommission (Hrsg.): Europäisches Arzneibuch, 9. Ausgabe, Grundwerk 2017. Monografie: Cefapirin-Natrium.
- Externe Identifikatoren von bzw. Datenbank-Links zu Cefapirin-Natrium: CAS-Nummer: 24356-60-3, EG-Nummer: 246-194-2, ECHA-InfoCard: 100.041.980, PubChem: 23675312, ChemSpider: 390127, DrugBank: DBSALT000264, Wikidata: Q27106128., IUPAC-Name: Natrium[(6R,7R)-3-[(acetyloxy)methyl]-8-oxo-7-[[[(pyridin-4-yl)sulfanyl]acetyl]amino]-5-thia-1-azabicyclo[4.2.0]oct-2-en-2-carboxylat].
- Externe Identifikatoren von bzw. Datenbank-Links zu Cefapirin-Benzathin: CAS-Nummer: 97468-37-6, EG-Nummer: 619-270-1, ECHA-InfoCard: 100.108.326, PubChem: 167441, ChemSpider: 146482, Wikidata: Q27271322.
- Eintrag zu Cefapirin bei Vetpharm, abgerufen am 20. Mai 2019.
- Alle Bruggink (Hrsg.): Synthesis of β-Lactam Antibiotics: Chemistry, Biocatalysis & Process Integration. Springer Science+Business Media, ISBN 978-0-7923-7060-4, S. 15.
- Eintrag zu Cephapirin in der Hazardous Substances Data Bank, abgerufen am 27. Mai 2019 (online auf PubChem).