Carbamidsäuren
Carbamidsäuren sind die Monoamide der Kohlensäure.
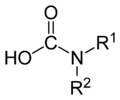
Die Carbamidsäure ist die einfachste, weil N-unsubstituierte (R1=R2=H) Carbamidsäure. Gelegentlich wird auch noch die veraltete Bezeichnung Carbaminsäure verwendet. Ester und Salze von Carbamidsäuren werden Carbamate genannt; die Ester werden häufig noch als Urethane bezeichnet.[1]
Die allgemeine Formel für Carbamidsäuren lautet R2N-COOH, wobei R = H, Alkyl oder Aryl sein kann und die beiden Reste R gleich oder verschieden sein können.
Herstellung
Monosubsituierte Carbamidsäuren bilden sich leicht aus Isocyanaten und Wasser:
In der Regel zerfallen Carbamidsäuren in ein Amin und Kohlenstoffdioxid:
Bei der Herstellung von Schaumstoffen aus Polyurethanen bedient man sich dieser Reaktion, um den Kunststoff aufzuschäumen; bei Beschichtungen ist dies aber unerwünscht und muss durch geeignete Formulierung vermieden werden.[2]
Auch bei der Reaktion von Aminen mit Kohlenstoffdioxid entstehen Carbamidsäuren:
Die Säure reagiert mit überschüssigem Amin zum entsprechenden Carbamat, so dass die Rückreaktion verhindert wird. Aus Ammoniak und Kohlenstoffdioxid entsteht so Ammoniumcarbamat. Bei technischen Anwendungen, wie der Härtung von Epoxidharzen mit Aminen, kann die Bildung von Carbamaten zu Problemen führen – hier führt die Reaktion mit Kohlenstoffdioxid aus der Luft zu klebrigen Oberflächen und weißen Verfärbungen.[2]
Eigenschaften
In der freien Form sind Carbamidsäuren zwar meistens, aber nicht immer instabil. Das hängt stark von den Resten R und auch vom pH-Wert ab. Elektronenziehende und zu Mesomeriestabilisierungen neigende Reste (z. B. 4-Nitrophenyl) vermindern die Basizität des Stickstoffs und stabilisieren die betreffende Carbamidsäure. Auch sterisch anspruchsvollere Reste (als Methyl) stabilisieren das Molekül.
Es gibt etliche Beispiele für Carbamidsäuren, die auch im freien Zustand so stabil sind, dass sie in Flaschen gefüllt im Chemikalienhandel erhältlich sind, zum Beispiel Butylmethylcarbaminsäure, 1,4-Piperazindicarbonsäure, Benzimidazol-N-carbonsäure, Prolin-N-carbonsäure. Selbst mit nur einem Rest am Stickstoff können sie stabil sein, z. B. die (o-Tolyl)carbamidsäure, oder die 3-Pyridylcarbamidsäure.
Die Anionen sind oft erstaunlich stabil, da der Stickstoff dann nicht protoniert ist. Da die C-N-Bindung bevorzugt dann gelöst werden kann, wenn der Stickstoff protoniert und damit positiv geladen ist (Stichwort: gute Austrittsgruppe, analog zur so genannten Hofmann-Eliminierung) zerfällt eine Carbamidsäure besonders leicht im sauren Medium zu R2NH und CO2.
Als Zwischenprodukt treten Carbamidsäuren beim Säureamid-Abbau nach Hofmann, beim Säurehydrazid-Abbau nach Curtius und beim Säureazid-Abbau nach Schmidt auf. Dabei wird stets Kohlendioxid abgespalten und ein primäres Amin gebildet.[3]
Auch die Übertragung von Kohlenstoffdioxid durch Carboxylasen mit Biotin als prosthetischer Gruppe verläuft über eine Carbamidsäure als Zwischenprodukt.[4]
Einzelnachweise
- Eintrag zu Urethane. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juni 2014.
- Kittel: Lehrbuch der Lacke und Beschichtungen, 2. Aufl., Band 2: Bindemittel für lösemittelhaltige und lösemittelfreie Systeme, Hrsg. Walter Krauß, s. Hirzel Verlag 1998, ISBN 3-7776-0886-6.
- Beyer-Walter: Lehrbuch der Organischen Chemie, 23. Auflage, S. Hirzel Verlag 1998.
- Römpp CD 2006, Georg Thieme Verlag 2006.