Bariumiodat
Bariumiodat ist das Bariumsalz der Iodsäure.
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
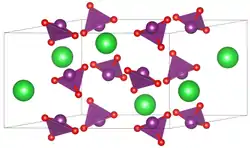 | ||||||||||
| _ Ba2+ _ I5+ _ O2− | ||||||||||
| Kristallsystem |
monoklin | |||||||||
| Raumgruppe |
C2/c (Nr. 15) | |||||||||
| Gitterparameter |
a = 13,638(9) Å, b = 7,979(2) Å, c = 9,036(6) Å, β = 133,62(4)°[1] | |||||||||
| Allgemeines | ||||||||||
| Name | Bariumiodat | |||||||||
| Verhältnisformel | Ba(IO3)2 | |||||||||
| Kurzbeschreibung |
weiße Kristalle[2] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | ||||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte | ||||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Herstellung
Bariumiodat kann durch Kochen einer wässrigen Lösung von Bariumchlorid mit Kaliumiodat hergestellt werden. Die Synthese ist ähnlich der des Strontiumiodats, jedoch muss dort das Reaktionsgemisch nicht gekocht werden.[4]
Eigenschaften
Physikalische Eigenschaften
Bariumiodat kristallisiert als Monohydrat Ba(IO3)2 · H2O im monoklinen Kristallsystem.[4] Die Kristalle geben bei 130 °C ihr Kristallwasser ab[3] und sind mit den Kristallen von Bariumchlorat und Bariumbromat isomorph.[4] Es ist schwerlöslich in Wasser, die Löslichkeit nimmt mit steigender Temperatur zu. In Säuren ist die Löslichkeit größer.[4] Auch ein Hexahydrat wurde beschrieben.[5]
Das Löslichkeitsprodukt des Monohydrates beträgt bei 25 °C 2,7 · 10−9 mol3/l3.[5]
Chemische Eigenschaften
Beim Erhitzen zersetzt es sich unter Entwicklung von Sauerstoff- und Iod, es bleibt ein Doppelsalz zurück:[4]
Versetzt man Bariumiodat mit verdünnter Schwefelsäure, fällt Bariumsulfat aus und Iodsäure wird frei:[4]
Einzelnachweise
- Václav Petříček, Karel Malý, Bohumil Kratochvíl, Jana Podlahová, Josef Loub: Barium diiodate. In: Acta Crystallographica Section B. B36, 1980, S. 2130–2132, doi:10.1107/S0567740880008102.
- Datenblatt Barium iodate monohydrate bei AlfaAesar, abgerufen am 7. Dezember 2019 (PDF) (JavaScript erforderlich).
- Dale L. Perry, Sidney L. Phillips (Hrsg.): Handbook of inorganic compounds. CRC Press, Boca Raton FL u. a. 1995, ISBN 0-8493-8671-3, S. 51 (eingeschränkte Vorschau in der Google-Buchsuche).
- Richard Abegg, Friedrich Auerbach: Handbuch der anorganischen Chemie in vier Bänden. Band 2, Abteilung 2: Die Elemente der zweiten Gruppe des periodischen Systems. S. Hirzel, Leipzig 1905, S. 270 (Volltext).
- Richard C. Ropp: Encyclopedia of the Alkaline Earth Compounds. Elsevier Science & Technology Books, Amsterdam 2012, ISBN 978-0-444-59550-8 (eingeschränkte Vorschau in der Google-Buchsuche).

