Atractylosid
Atractylosid (ATR) ist ein natürliches, giftiges Glycosid und ein effektiver Inhibitor des ATP/ADP-Translokators.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
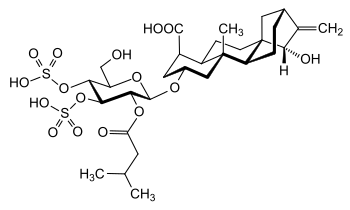 | |||||||||||||||||||
| protonierte Form von Atractylosid, stereochemische Darstellung | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Atractylosid | ||||||||||||||||||
| Andere Namen |
ATR | ||||||||||||||||||
| Summenformel | C30H46O16S2 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 726,81 g·mol−1 | ||||||||||||||||||
| Löslichkeit |
löslich Wasser: 20 mg·ml−1 (Dikaliumsalz)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen

Das Glycosid wird von einigen Pflanzenarten synthetisiert, beispielsweise von Atractylis gummifera (Leimdistel) aus der Familie der Korbblütler (Asteraceae). Weitere Pflanzen, ebenfalls aus der Familie der Korbblütler, sind die in unterschiedlichen Teilen der Welt beheimateten Arten Callilepis laureola, Xanthium strumarium, Iphiona aucheri, Pascalia glauca oder Wedelia glauca.[3]
Geschichtliches
Die giftige Wirkung der Leimdistel (Atractylis gummifera, Syn.: Carlina gummifera), die auf Atractylosid zurückgeht, war bereits in der Antike bekannt. Die im mediterranen Raum wachsende Pflanze wurde daher häufig für Selbstmorde oder Morde verwendet. Beispiele eines versehentlichen Vergiftens sind in Italien 1955 und in Algerien 1975 dokumentiert, bei denen Kinder Teile der Pflanze gegessen hatten.[4][5] Es sind auch Vergiftungen bei falscher Dosierung traditioneller Kräutermedizin in Süd- und Nordafrika bekannt.
1868 isolierte Ed Lefranc[6] das Glycosid aus dem Rhizom der Leimdistel.[3] Die Struktur wurde ca. 100 Jahre später bestimmt.[7]
Eigenschaften
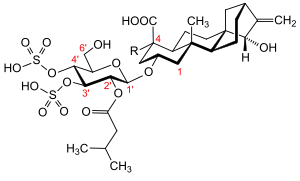

Atractylosid ist ein hydrophiles Glycosid. Dabei ist eine modifizierte Glucose β-glycosidisch an das hydrophobe Diterpen Atractyligenin, einem Kauran-Derivat, verknüpft. Atractyligenin ist damit das Aglycon. Bei diesem ist an der C4-Position eine Carboxygruppe in axialer Stellung positioniert. Der Glucoseteil ist am C2'-Atom mit Isovaleriansäure verestert, an den C3'- und C4'-Atomen mit Schwefelsäure. Durch Hydrolyse erhält man infolgedessen je ein Molekül D-(+)-Glucose, Isovaleriansäure und Atractyligenin, und zwei Moleküle Schwefelsäure. Die beiden Sulfatgruppen und die Carboxygruppe in ATR liegen unter physiologischen Bedingungen in einer deprotonierten Form vor. Damit ist ATR dreifach negativ geladen.
Eine modifizierte Variante des Atractylosids trägt eine zusätzliche Carboxygruppe am C4-Atom des Atractyligenins, sie wird dann als Carboxyatractylosid (CATR), manchmal auch als Gummiferin, bezeichnet.[8][9] Diese wird aber nach einiger Zeit spontan bzw. durch Erhitzen decarboxyliert. Dabei entsteht epi-ATR, bei dem die verbleibende Carboxygruppe am C4-Atom in äquatorialer Stellung ist.[10] Analysen röntgenkristallographischer Aufnahmen zeigen, dass auch an der ATP/ADP-Translokase gebundenes CATR als β-Glucosid vorliegt.[11]
Pharmakologische Eigenschaften
Bei biochemischen Untersuchungen von Mitochondrien wurde die spezifische Wirkung des Glycosids am ADP/ATP-Transport erkannt, noch bevor der eigentliche Transporter identifiziert wurde. So binden ATR bzw. CATR an die ATP/ADP-Translokase, die an der inneren Membran des Mitochondriums lokalisiert ist. Hierbei wird die Seite des Proteins gebunden, die zum Intermembranraum gerichtet ist. ATR bindet an die Translokase kompetitiv bis zu einer Konzentration von 5 mmol und CATR in einer nicht-kompetitiven Weise. Infolgedessen wird der Austausch von ADP bzw. ATP nicht mehr durchgeführt und die Zelle stirbt wegen Energiemangels.
Die chemische Struktur und die Ladungsverteilung von Atractylosid ähnelt der von ADP: So entsprechen die Sulfatgruppen den Phosphatgruppen, der Glucoseteil dem Riboseteil und der hydrophobe Atractyligeninrest dem hydrophoben Purinrest von ADP.
Die Carboxygruppe am C4-Atom des Atractyligenin ist für die Giftigkeit wichtig. Falls diese beispielsweise zu einer Hydroxygruppe reduziert wird (Atractylitriol), wird die Substanz ungiftig.[12] Durch einen Verlust der Sulfatgruppen bei ATR kann dieses nicht mehr am ADP/ATP-Translokator binden und verliert damit ebenso seine giftige Wirkung.[12]

Dagegen ist die freie Hydroxygruppe am C6'-Atom des Glucoseteils modifizierbar, ohne dass die Toxizität ATRs beeinträchtigt wird.
Das Aglycon ist etwa 150-mal weniger giftig als ATR, während CATR aufgrund seiner irreversiblen Bindung 10-mal toxischer als ATR ist.[3]
Vergiftung
Atractylosid und Carboxyatractylosid verursachen gastrointestinale Blutungen und Lebernekrose.[13] Die mittlere letale Dosis (LD50) bei Ratten (i.p.) beträgt für ATR 143 mg·kg−1, für CATR 2,9 mg·kg−. Bei Hunden (i.v.) liegt diese für ATR bei 15 mg·kg−1.[3]
Ähnliche Glycoside
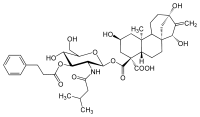

Das Glycosid aus Wedelia asperrima, Wedelosid, ähnelt ATR.[14] Auch die Kaffeepflanze Coffea arabica produziert ein ATR-ähnliches Glycosid. So enthalten geröstete Kaffeebohnen 2-O-β-D-Glucopyranosylatractyligenin[15], außerdem auch dessen am C4-Atom carboxylierte Variante 2-O-β-D-Glucopyranosylcarboxyatractyligenin.[3] Obwohl in allen Fällen die Sulfatgruppen fehlen, inhibieren diese den ADP/ATP-Translokator auch hochaffin. Die biologische Bedeutung ist aber noch nicht bekannt. Quantitative Studien zeigen aber, dass in Folge des Röstprozesses die im Kaffee enthaltenen giftigen Glycoside vollständig abgebaut werden.[3]
Einzelnachweise
- Datenblatt Atractyloside potassium salt bei Sigma-Aldrich, abgerufen am 9. März 2011 (PDF).
- M. J. Stewart, V. Steenkamp: The biochemistry and toxicity of atractyloside: a review. In: Ther Drug Monit. 22(6), 2000, S. 641–619. PMID 11128230
- Roman Lang u. a.: 2-O-β-D-Glucopyranosyl-carboxyatractyligenin from Coffea L. inhibits adenine nucleotide translocase in isolated mitochondria but is quantitatively degraded during coffee roasting. In: Phytochemistry. Band 93, September 2013, S. 124–135, doi:10.1016/j.phytochem.2013.03.022, PMID 23642386.
- R. Santi, G. Cascio: Ricerche farmacologiche sul principio attivo dell' Atractylis gummifera. 1. Accione generale. In: Arch Ital Sci Farmacol. 5, 1955, S. 534–563.
- G. Lemaigre u. a.: Fulminating hepatitis caused by glue thistle (Atractylis glummifera-L.), poisoning. Anatomo-pathological study of 4 cases. In: Nouv Presse Med. 4(40), 1975, S. 2565–2568. PMID 1215192.
- E. Lefranc: Sur l’acide atractylique et les atractylates, produits immédiats de la racine de l’Atractylis gummifera. In: Compt. Rend. 67, 1868, S. 954–961.
- F. Piozzi: u. a.: The structure and stereochemistry of atractyligenin. In: Tetrahedron. 22 (Supplement 8), 1966, S. 515–529; doi:10.1016/S0040-4020(01)90959-7.
- B. Danieli u. a.: Structure of the diterpenoid carboxyatractyloside. In: Phytochemistry. 11(12), 1972, S. 3501–3504, doi:10.1016/S0031-9422(00)89846-5.
- P. V. Vignais u. a.: Adenosine diphosphate translocation in mitochondria. Nature of the receptor site for carboxyatractyloside (gummiferin). In: Biochemistry. 12(8), 1973, S. 1508–1519. PMID 4699983, doi:10.1021/bi00732a007.
- M. Klingenberg: The ADP and ATP transport in mitochondria and its carrier. In: Biochim Biophys Acta 1778(10), 2008, S. 1978–2021. PMID 18510943, doi:10.1016/j.bbamem.2008.04.011.
- Jean-Frédéric Sanchez u. a.: Unambiguous structure of atractyloside and carboxyatractyloside. In: Bioorganic & Medicinal Chemistry Letters. Band 22, Nr. 8, 15. April 2012, S. 2973–2975, doi:10.1016/j.bmcl.2012.02.040, PMID 22425567.
- P. V. Vignais u. a.: Effects of atractyligenin and its structural analogues on oxidative phosphorylation and on the translocation of adenine nucleotides in mitochondria. In: Biochim Biophys Acta. 118(3), 1966, S. 465–483. PMID 4226320.
- Jean-Frédéric Sanchez u. a.: Unambiguous structure of atractyloside and carboxyatractyloside. In: Bioorganic & Medicinal Chemistry Letters. Band 22, Nr. 8, 15. April 2012, S. 2973–2975, doi:10.1016/j.bmcl.2012.02.040, PMID 22425567.
- I. A. S. Lewis u. a.: The toxic extractives from wedelia asperrima—II : The structure of wedeloside, a novel diterpenoid aminoglycoside. In: Tetrahedron. 37(24), 1981, S. 4305–4311, doi:10.1016/0040-4020(81)85026-0.
- H. Obermann, G. Spiteller: Die Strukturen der Kaffee-Atractyloside. In: Chemische Berichte. 109(10), 1976, S. 3450–3461, doi:10.1002/cber.19761091024.
Literatur
- C. Dahout-Gonzalez u. a.: Molecular, functional, and pathological aspects of the mitochondrial ADP/ATP carrier. In: Physiology (Bethesda). 21, 2006, S. 242–249. PMID 16868313, doi:10.1152/physiol.00005.2006.
- M. Klingenberg: The ADP and ATP transport in mitochondria and its carrier. In: Biochim Biophys Acta. 1778(10), 2008, S. 1978–2021. PMID 18510943, doi:10.1016/j.bbamem.2008.04.011
- M. J. Stewart, V. Steenkamp: The biochemistry and toxicity of atractyloside: a review. In: Ther Drug Monit. 22(6), 2000, S. 641–619. PMID 11128230
