Ascaridol
Ascaridol ist eine chemische Verbindung und ein pflanzlicher Naturstoff. Es handelt sich um ein monocyclisches Monoterpen-Peroxid mit nicht eindeutig aufgeklärter absoluter Konfiguration. 1943 konnte es zum ersten Mal durch Günther Otto Schenck und Karl Ziegler synthetisch hergestellt werden.[4] Es wird aus Pinen und Sauerstoff in Anwesenheit von Chlorophyll synthetisiert. Früher wurde es als Anthelminthikum eingesetzt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
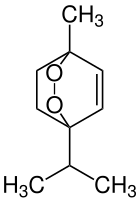 | |||||||||||||||||||
| Strukturformel ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ascaridol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C10H16O2 | ||||||||||||||||||
| Kurzbeschreibung |
schwach grünlichgelbe Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 168,23 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,01 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
113–114 °C (2,6 kPa), explosionsartige Zersetzung >130 °C[1] | ||||||||||||||||||
| Löslichkeit |
kaum löslich in Wasser[1] | ||||||||||||||||||
| Brechungsindex |
1,4769 (20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen

Ascaridol findet sich im so genannten Wohlriechenden Gänsefuß (Wurmkraut) sowie in dem Öl der Boldoblätter. Ascaridol ist aufgrund der Peroxid-Gruppe instabil.
Historisches
Ascaridol war das erste entdeckte in der Natur vorkommende organische Peroxid. Es wurde isoliert aus Pflanzen der Gattung Gänsefüße (Chenopodium). Hüthig erkannte bereits 1908 den explosiven Charakter von Ascaridol und bestimmte die Summenformel mit C10H16O2. Bei der Reaktion von Ascaridol mit Schwefelsäure oder bei der Reduktion mit Zink-Pulver/Essigsäure bildet sich p-Cymol.[5][6] Diese Ergebnisse wurden 1911 von E. K. Nelson bestätigt. Nelson zeigte eindeutig, dass Ascaridol weder eine Hydroxy- noch eine Carbonylgruppe enthält. Ein fast korrekter Strukturvorschlag von Nelson[7] wurde 1912 durch Otto Wallach korrigiert.[8][9][10][11]
Die erste Laborsynthese gelang 1944 Günther Otto Schenck und Karl Ziegler. Das Edukt α-Terpinen reagiert dabei mit Sauerstoff in Gegenwart von Chlorophyll und Licht. Bei diesen Reaktionsbedingungen wird photochemisch zuerst Singulett-Sauerstoff erzeugt, der in einer Hetero-Diels-Alder-Reaktion mit dem Diensystem im Terpinen reagiert.[11][12][13] Bereits 1945 wurde diese Reaktion in Deutschland industriell weiterentwickelt zu einem technischen Verfahren zur Herstellung großer Mengen Ascaridol. Ascaridol wurde als preisgünstiger Arzneistoff gegen Würmer eingesetzt.[14]
Physiologische Wirkung
Ascaridol ist allergieauslösend. Als Abbauprodukt von Monoterpenen u. a. im Teebaumöl ist es für die Allergenität mancher ätherischer Öle verantwortlich.[15]
Weblinks
Einzelnachweise
- Eintrag zu Ascaridol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 8. Juni 2014.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-29.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Günther, O. Schenck, K. Ziegler: Die Synthese des Ascaridols. In: Die Naturwissenschaften. 32, 1944, S. 157–157, doi:10.1007/BF01467891.
- Schimmel's Report April 1908, S. 108.
- Yu. A. Arbuzov: The Diels–Alder Reaction with Molecular Oxygen as Dienophile. In: Russian Chemical Reviews. 34, Nr. 8, 1965, S. 558. doi:10.1070/RC1965v034n08ABEH001512.
- E. K. Nelson: A Chemical Investigation of the Oil of Chenopodium. In: Journal of the American Chemical Society. 33, Nr. 8, 1911, S. 1404–1412. doi:10.1021/ja02221a016.
- Wallach, O.: in Justus Liebigs Annalen der Chemie 392 (1912) 61.
- Wallach, O.: in Chemisches Zentralblatt 83 (1912) 921.
- E. K. Nelson: A Chemical Investigation of the Oil of Chenopodium. II. In: Journal of the American Chemical Society. 35, 1913, S. 84–90. doi:10.1021/ja02190a009.
- CUP Archive: The Terpenes. CUP Archive, S. 446–452 (eingeschränkte Vorschau in der Google-Buchsuche).
- Pape, M.: Industrial Applications of Photochemistry. (pdf) In: Pure and Applied Chemistry. 41, Nr. 4, 1975, S. 535–558.
- Schenck, G. O.; Ziegler, K.: Die Synthese des Ascaridols. In: Naturwissenschaften. 32, Nr. 14–26, S. 157. doi:10.1007/BF01467891.
- William Brown: Organic Chemistry. Cengage Learning, 2008, ISBN 978-0-495-38857-9, S. 967 (eingeschränkte Vorschau in der Google-Buchsuche).
- B. M. Hausen et al.: Degradation products of monoterpenes are the sensitizing agents in tea tree oil. Am J Contact Dermat. 10/2/1999. S. 68–77; PMID 10357714.