Apricitabin
Apricitabin (SPD754, AVX754) ist ein experimenteller Arzneistoff zur Behandlung von HIV-infizierten Patienten im Rahmen einer HIV-Kombinationstherapie.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
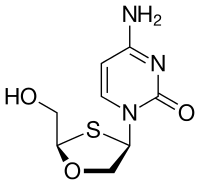 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Apricitabin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C8H11N3O3S | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Wirkmechanismus | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 229,26 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Er gehört zur Gruppe der nukelosidischen Reverse-Transkriptase-Inhibitoren (NRTI).
Geschichte
Apricitabin wird derzeit von Avexa Pharmaceuticals, einem australischen Pharmaunternehmen, entwickelt und getestet. Phase-IIb-Studien wurden 2006 abgeschlossen.[2]
Der Wirkstoff wurde ursprünglich von BioChem Pharma als BCH10618 entwickelt. Nach dem Verkauf an Shire Pharmaceuticals wurde der Wirkstoff in SPD754 umbenannt. Shire verkaufte anschließend die Rechte an Avexa (AVX754).[3]
Pharmakologie
Apricitabin wurde in verschiedenen Studien untersucht. Ergebnis der Studien ist, dass unter Apricitabin-Monotherapie die beste Virus-Suppression bei einer Dosierung von 1200 mg erreicht wurde. Der Wirkstoff war in der Lage, die Viruslast um bis zu 1,65 Logstufen zu reduzieren.[4]
Die Ähnlichkeit zu den Wirkstoffen Lamivudin (Epivir®) und Emtricitabin (Emtriva®) macht eine Kombination mit ihnen sinnlos.[3]
Pharmakokinetik
Apricitabin wurde in Studien schnell aufgenommen und hauptsächlich renal metabolisiert. Die höchsten Plasmaspiegel werden nach 1,5 bis 2,5 Stunden erreicht.[5]
Nebenwirkungen
Apricitabin war in den bisherigen Studien gut verträglich.[4]
Resistenzen
In den früheren Studien wurden keine therapiebedingten Resistenzmutationen beobachtet.[4]
In vitro zeigte Apricitabin gute Aktivität gegen NRTI-resistente Stämme (einschließlich Zidovudin (Retrovir®) und Lamivudin (Epivir®) ). Frühere Studien zeigten, dass Apricitabin auch gegen Stämme mit Epivir-Resistenz wirksam ist. Neue Studien zeigen, dass der Wirkstoff K65R-Mutationen mit Resistenz gegen Didanosin (Videx®) und Tenofovir (Viread®) hervorrufen kann.[3]
In zukünftigen Studien wird abzuklären sein, ob der Wirkstoff tatsächlich für die K65R-Mutation verantwortlich ist.
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Avexa und Novasep geben Unterzeichnung von Vertrag über die Produktion von Apricitabin bekannt.
- AIDSmeds.com: Apricitabine (Memento vom 21. März 2008 im Internet Archive)
- P. Cahn, I. Cassetti, R. Wood, P. Phanuphak, L. Shiveley, R. C. Bethell, J. Sawyer: Efficacy and tolerability of 10-day monotherapy with apricitabine in antiretroviral-naive, HIV-infected patients. In: AIDS. 20(9), 12 Jun 2006, S. 1261–1268. PMID 16816554.
- P. Cahn, M. Rolon, I. Cassetti, L. Shiveley, T. Holdich, J. Sawyer: Multiple-dose pharmacokinetics of apricitabine, a novel nucleoside reverse transcriptase inhibitor, in patients with HIV-1 infection. In: Clin Drug Investig. 28(2), 2008, S. 129–138. PMID 18211121.