Alkinmetathese
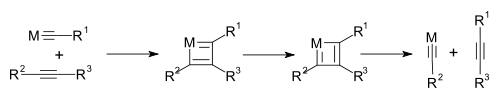
Bei der Alkinmetathese handelt es sich um eine organische Reaktion, in der Substituenten an einer alkinischen Dreifachbindungen ausgetauscht werden.[1] Die Reaktion ist eng verwandt mit der Alkenmetathese.
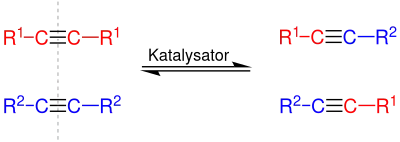
Die Metall-katalysierte Alkinmetathese wurde zuerst von Bailey et al. 1968 beschrieben. Die Arbeitsgruppe nutzte als Katalysator eine Mischung aus Wolfram und Siliciumdioxid bei Temperaturen bis 450 °C. 1974 veröffentlichte Mortreux Ergebnisse, dass ein homogener Katalysator (Molybdänhexacarbonyl bei 160 °C) ebenfalls in der Lage sei, alkinische Dreifachbindungen auszutauschen; ein nicht-symmetrisch substituiertes Alkin reagierte in einer Gleichgewichtsreaktion zu den beiden symmetrisch substituierten Alkinen.[2]
Geschichte
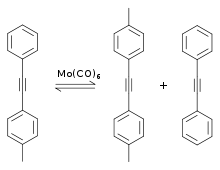
Das Mortreux-System besteht aus dem Katalysator Molybdänhexacarbonyl Mo(CO)6 und einem Resorcin-Cokatalysator. 1975 schlug T. J. Katz ein Ethinylmetall und ein Metallacyclobutadien als Intermediat vor. Richard R. Schrock charakterisierte 1981 diverse katalytisch aktive Metallacyclobutadien-Komplexe.
Tri-tert-butoxyneopentylidinwolfram(VI) ist ein gegenüber Alkenen unreaktiver Schrock-Katalysator.[3] (Fischer-Carbene sind für Alkin- und Alkenmetathesereaktionen nicht zu gebrauchen.)
Der Schrock-Katalysator ist kommerziell verfügbar. Er wird hergestellt, indem im ersten Schritt Wolfram(IV)-chlorid mit Lithiumdimethylamid zu W2(NMe2)6 amidiert wird. Die entstehende Verbindung wird dann mit tert-Butanol umgesetzt. Schließlich wird eine Metathese-Reaktion des Komplexes mit Neohexin zum Endprodukt durchgeführt.
Ringschlüsse mittels Alkinmetathese
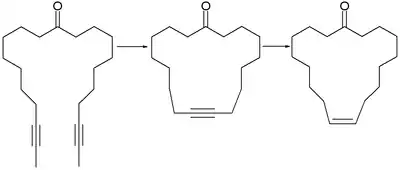
Die Alkinmetathese wird häufig eingesetzt, um Ringschluss-Reaktionen durchzuführen. Der Duftstoff Zibeton kann beispielsweise aus einem Diin dargestellt werden. Nach dem Ringschluss wird die Dreifachbindung stereoselektiv mit Wasserstoff an einem Lindlar-Katalysator hydriert, um nur das Z-Isomer zu erhalten. (Das E-Isomer könnte durch eine Reduktion mit einem Alkalimetall in flüssigem Ammoniak und einer schwachen Säure wie Ethanol erhalten werden.) Eine wichtige Triebkraft für solche Reaktionen ist das Ausgasen kleiner Moleküle wie Ethin oder 2-Butin.
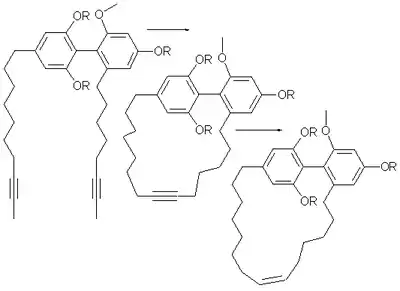
Die gleiche Prozedur wurde in der Synthese des natürlich vorkommenden Cyclophans Turrian genutzt.
Kreuz-Metathese mit Nitril und Alkin
In dieser Kreuz-Metathese wird statt einer Alkylidinwolfram-Verbindung ein Wolframnitrid genutzt. Auf diese Weise können zwei Nitrile gekoppelt werden, wobei ein Alkin entsteht. Der Stickstoff geht dabei auf ein Opfer-Alkin über, es entsteht also kein elementarer Stickstoff:[4][5]
Einzelnachweise
- Fürstner, A.; Davies, P. W.: Alkyne metathesis. In: Chemical Communications. Nr. 18, 2005, S. 2307–2320. doi:10.1039/b419143a.
- Fürstner, A.; Mathes, C.; Lehmann, C. W.: Mo[N(t-Bu)(Ar)]3 Complexes As Catalyst Precursors: In Situ Activation and Application to Metathesis Reactions of Alkynes and Diynes. In: J. Am. Chem. Soc.. 121, Nr. 40, 1999, S. 9453–9454. doi:10.1021/ja991340r.
- R. R. Schrock, D. N. Clark, J. Sancho, J. H. Wengrovius, S. M. Rocklage, S. F. Pedersen: Tungsten(VI) neopentylidyne complexes. In: Organometallics. 1, 1982, S. 1645–1651, doi:10.1021/om00072a018.
- Geyer, A. M.; Gdula, R. K.; Wiedner, E. S.; Johnson, M. J. A.: Catalytic Nitrile-Alkyne Cross-Metathesis. In: J. Am. Chem. Soc.. 129, Nr. 13, 2007, S. 3800–3801. doi:10.1021/ja0693439.
- Ritter, S.: Nitrile-Alkyne Cross-Metathesis. In: Chemical & Engineering News, 26. März 2007.