Afatinib
Afatinib (zugelassen als Giotrif; Hersteller: Boehringer Ingelheim) ist ein Wirkstoff aus der Gruppe der Tyrosinkinase-Inhibitoren, der in der Behandlung von metastasiertem nicht-kleinzelligen Lungenkrebs eingesetzt wird.[7][8]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
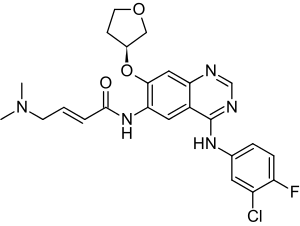 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Afatinib | |||||||||||||||||||||
| Andere Namen |
4-[(3-Chlor-4-fluorphenyl)amino]-6-{[4-(N,N-dimethylamino)-1-oxo-2-buten-1-yl]amino}-7-[(S)-tetrahydrofuran-3-yloxy]-chinazolin | |||||||||||||||||||||
| Summenformel | C24H25ClFN5O3 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer bis brauner Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
L01XE13 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 485,95 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt |
100–102 °C[3] | |||||||||||||||||||||
| pKS-Wert |
11,79[4] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Klinische Angaben
Anwendungsgebiete (Indikationen)
Afatinib ist ein von der FDA 2013 zugelassener Wirkstoff zur Behandlung bei erwachsenen Patienten mit lokal fortgeschrittenem und/oder metastasiertem nicht-kleinzelligen Bronchialkarzinom (NSCLC = non small cell lung carcinoma) mit aktivierenden EGFR-Mutationen. Dabei muss vorher ein Test auf EGFR-Mutationen positiv ausfallen. Eine Verwendung in der Therapie von Brustkrebs und Plattenepithelkarzinomen des Kopfes und Halses (SCCHN = squamous cell carcinoma of head and neck) wird untersucht.[9][10]
Art und Dauer der Anwendung
Die Tabletten werden peroral einmal täglich nüchtern eingenommen. Afatinib soll nicht gemeinsam mit Nahrung eingenommen werden; d. h. mindestens 3 Stunden vor und mindestens 1 Stunde nach Einnahme dieses Arzneimittels sollte keine Nahrung zu sich genommen werden.[11]
Gegenanzeigen (Kontraindikationen)
Bei Patienten mit schwerer Beeinträchtigung der Nieren- und Leberfunktion wird die Therapie nicht empfohlen, evtl. Dosisanpassung.
Wechselwirkungen mit anderen Medikamenten
Die gleichzeitige Behandlung mit starken P-Glykoprotein-Induktoren können die Afatinib-Plasmaspiegel verringern, bzw. P-Glykoprotein-Inhibitoren erhöhen.
Anwendung während Schwangerschaft und Stillzeit
Der Wirkstoff ist in der Schwangerschaft und Stillzeit kontraindiziert.
Unerwünschte Wirkungen (Nebenwirkungen)
Die häufigsten Nebenwirkungen, die auftreten können, sind Diarrhö, Stomatitis, Paronychie, verminderter Appetit, Geschmacksstörung und Hautausschläge.[12][13] Bei mit 40 mg Afatinib behandelten Patienten können Anstiege der Konzentrationen von Leberenzymen wie ALAT oder ASAT beobachtet werden, wobei diese meist vorübergehend sind.
Pharmakologische Eigenschaften
Wirkungsmechanismus (Pharmakodynamik)
Afatinib ist ein starker und selektiver Inhibitor der ErbB-Familie von Rezeptortyrosinkinasen,[14] bindet als Michael-Akzeptor über Cys-Rest des EGFR an alle von den Mitgliedern der Erb-B-Familie EGFR (ErbB1), HER2 (ErbB2), ErbB3 und ErbB4 gebildeten Homo- und Heterodimere und blockiert irreversibel die Signaltransduktion über diese Rezeptoren.
Aufnahme und Verteilung im Körper (Pharmakokinetik)
Afatinib bindet in vitro 95 % an menschliche Plasmaproteine, sowohl kovalent als auch nicht kovalent. Die Elimination erfolgt über den Stuhl. Die Plasmahalbwertszeit beträgt etwa 37 Stunden. Der LogP-Wert beträgt 1,569.
Sonstige Informationen
Afatinib kann das Reaktionsvermögen beeinträchtigen, insbesondere wenn zusätzlich Alkohol getrunken wird.
Reaktivitätsanalytik
Zur qualitative Analyse erfolgt der Nachweis auf tertiäre Amine durch Alkylierung mittels Alkylhalogeniden oder auf Doppelbindungen mit der Baeyer-Probe. Zur quantitativen Analyse eignet sich aufgrund der basischen tertiären Amine eine alkalimetrische Titration.
FT-IR
FT-IR: (cm−1): 3547.4, 2980.2, 2947.8, 2865.7, 2774, 1673.1, 1626.9, 1575.8, 1536.1, 1500.1, 1455.7, 1430.5, 1397.0, 1233.4, 1147.1, 981.9, 852.1, 778.5, 660.9.[15]
Massenspektroskopie
Lösungsmittel: Methanol. Afatinib ist beim Peak 486 m/z und 488 m/z zu finden.[16]
Frühe Nutzenbewertung
In Deutschland müssen seit 2011 neu zugelassene Medikamente mit neuen Wirkstoffen gemäß § 35a SGB V einer „frühen Nutzenbewertung“ durch den Gemeinsamen Bundesausschuss (G-BA) unterzogen werden, wenn der pharmazeutische Hersteller einen höheren Verkaufspreis als nur den Festbetrag erzielen möchte. Nur wenn ein Zusatznutzen besteht, kann der Arzneimittelhersteller mit dem Spitzenverband der gesetzlichen Krankenkassen einen Preis aushandeln. Die Dossierbewertungen, auf deren Basis der G-BA seine Beschlüsse fasst, erstellt das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG).
Der erste G-BA-Beschluss vom 8. Mai 2014 wurde durch ein weiteres Nutzenbewertungsverfahren aufgehoben.[17] 2015 wurde der Zusatznutzen von Afatinib zur Behandlung EGFR-TKI-naiver Erwachsener mit lokal fortgeschrittenem und/oder metastasiertem nicht-kleinzelligen Lungenkarzinom (NSCLC) mit aktivierenden EGFR-Mutationen bewertet.[18] Gemäß G-BA-Beschluss gibt es einzig für nicht vorbehandelte Patienten mit ECOG-Performance-Status 0 oder 1 und der EGFR-Mutation Del19 gegenüber der zweckmäßigen Vergleichstherapie Cisplatin plus Pemetrexed einen Hinweis auf einen erheblichen Zusatznutzen. Für andere EGFR-Mutationen, für Betroffene mit ECOG-Performance-Status 2 sowie nach Vorbehandlung mit einer Platin-basierten Chemotherapie ist ein Zusatznutzen ist nicht belegt.[19] 2016 wurde nach einer Erweiterung des Anwendungsgebiets Afatinib zur Behandlung von lokal fortgeschrittenem oder metastasiertem NSCLC mit Plattenepithel-Histologie, das unter oder nach Platin-basierter Chemotherapie fortschreitet, mit Docetaxel bzw. Best Supportive Care verglichen.[20] Gemäß G-BA-Beschluss ist ein Zusatznutzen für diese Patienten nicht belegt.[21]
Einzelnachweise
- EU: EMA/491185/2013, Committee for Medicinal Products for Human Use - Giotrif - Procedure No. EMEA/H/C/002280 (PDF; 5,0 MB)
- Eintrag zu Afatinib bei ChemBlink, abgerufen am 2. Februar 2014.
- Patent WO2007085638: Process for preparing aminocrotonylamino-substituted quinazoline derivatives. Veröffentlicht am 2. August 2007, Erfinder: Jürgen Schröder, Georg Dziewas, Thomas Fachinger, Burkhard Jäger, Carsten Reichel, Svenja Renner.
- chembl: Compound Report Card
- eurodiagnostico: Afatinib Datsheet (PDF; 256 kB)
- Boehringer: Gilotrif MSDS (Memento vom 27. Dezember 2013 im Internet Archive).
- C. K. Lee, C. Brown, R. J. Gralla, V. Hirsh, S. Thongprasert, C. M. Tsai, E. H. Tan, J. C. Ho, d. a. Chu, A. Zaatar, J. A. Osorio Sanchez, V. V. Vu, J. S. Au, A. Inoue, S. M. Lee, V. Gebski, J. C. Yang: Impact of EGFR inhibitor in non-small cell lung cancer on progression-free and overall survival: a meta-analysis. In: Journal of the National Cancer Institute. Band 105, Nummer 9, Mai 2013, S. 595–605, doi:10.1093/jnci/djt072. PMID 23594426.
- B. C. Liao, C. C. Lin, J. C. Yang: First-line management of EGFR-mutated advanced lung adenocarcinoma: recent developments. In: Drugs. Band 73, Nummer 4, März 2013, S. 357–369, doi:10.1007/s40265-013-0020-8. PMID 23479407.
- E. Geuna, F. Montemurro, M. Aglietta, G. Valabrega: Potential of afatinib in the treatment of patients with HER2-positive breast cancer. In: Breast cancer (Dove Medical Press). Band 4, 2012, S. 131–137, doi:10.2147/BCTT.S25868. PMID 24367201. PMC 3846413 (freier Volltext).
- M. Agulnik: New approaches to EGFR inhibition for locally advanced or metastatic squamous cell carcinoma of the head and neck (SCCHN). In: Medical Oncology. Band 29, Nummer 4, Dezember 2012, S. 2481–2491, doi:10.1007/s12032-012-0159-2. PMID 22252310. PMC 3466428 (freier Volltext).
- Giotrif. In: Rote Liste 2016
- J. C. Yang, N. Reguart, J. Barinoff, J. Köhler, M. Uttenreuther-Fischer, U. Stammberger, D. O’Brien, J. Wolf, E. E. Cohen: Diarrhea associated with afatinib: an oral ErbB family blocker. In: Expert Review of Anticancer Therapy. Band 13, Nummer 6, Juni 2013, S. 729–736, doi:10.1586/era.13.31. PMID 23506556.
- M. E. Lacouture, D. Schadendorf, C. Y. Chu, M. Uttenreuther-Fischer, U. Stammberger, D. O’Brien, A. Hauschild: Dermatologic adverse events associated with afatinib: an oral ErbB family blocker. In: Expert Review of Anticancer Therapy. Band 13, Nummer 6, Juni 2013, S. 721–728, doi:10.1586/era.13.30. PMID 23506519.
- G. Giaccone, Y. Wang: Strategies for overcoming resistance to EGFR family tyrosine kinase inhibitors. In: Cancer treatment reviews. Band 37, Nummer 6, Oktober 2011, S. 456–464, doi:10.1016/j.ctrv.2011.01.003. PMID 21367530. PMC 3139833 (freier Volltext).
- Patent WO2012121764: Novel salts and polymorphic forms of Afatanib. Veröffentlicht am 13. September 2012, Erfinder: Ramesh Matioram Gidwani, Channaveerayya Hiremath, Manoj Dalsingar Yadav, Wolfgang Albrecht, Dirk Fischer.
- Patent US2003149062: Use of tyrosine kinase inhibitors for the treatment of inflammatory processes. Veröffentlicht am 7. August 2003, Erfinder: Birgit Jung, Hubert Püschner.
- Nutzenbewertungsverfahren zum Wirkstoff Afatinib - Beschluss aufgehoben. g-ba.de; abgerufen am 23. März 2020.
- A15-17 Afatinib - Nutzenbewertung gemäß § 35a SGB V (Dossierbewertung). iqwig.de; abgerufen am 23. März 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Afatinib (Neubewertung nach Fristablauf: nicht-kleinzelliges Lungenkarzinom, EGFR-Mutation, EGFR-TKI-naive Patienten). g-ba.de; abgerufen am 23. März 2020.
- A16-22 Afatinib (neues Anwendungsgebiet) - Nutzenbewertung gemäß § 35a SGB V. iqwig.de; abgerufen am 23. März 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Afatinib (neues Anwendungsgebiet: nicht-kleinzelliges Lungenkarzinom, Plattenepithelhistologie). g-ba.de; abgerufen am 23. März 2020.