3-Ketosäure–CoA-Transferase
3-Ketosäure–CoA-Transferasen (Scot) sind Enzyme, die Coenzym A von Succinyl-CoA auf γ-Ketosäuren (insbesondere Acetoacetat) übertragen. Dies ist der geschwindigkeitsbestimmende Reaktionsschritt im Abbau der Ketokörper; die anderen beiden Reaktionen sind Umkehrungen der Aufbaureaktionen. Scot-Enzyme werden in höheren Eukaryoten und manchen Bakterien gefunden. Im Mensch sind zwei Scot bekannt: 3-Ketosäure–CoA-Transferase 1 (Scot-S) und 3-Ketosäure–CoA-Transferase 2 (Scot-t).[1]
| 3-Ketosäure–CoA-Transferase 1 | ||
|---|---|---|
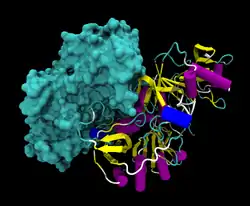
| ||
| Bänder/Oberflächenmodell des SCOT-Dimers nach PDB 3DLX | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 481 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Bezeichner | ||
| Gen-Name | OXCT1 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 2.8.3.5, Transferase | |
| Reaktionsart | Übertragung von CoA | |
| Substrat | Succinyl-CoA + 3-Ketosäure | |
| Produkte | Succinat + 3-Ketosäure-CoA | |
Die Anwesenheit von Scot im Gewebe zeigt an, ob dort Ketokörper abgebaut und als Energielieferant genutzt werden können. Beide Scot sind in der Mitochondrien-Matrix zu finden. Scot-S ist in der Leber nicht vorhanden, kann aber reichlich in Herz, Nieren, Gehirn und Muskeln nachgewiesen werden. Scot-t ist nur in den Hoden lokalisiert („testis“). Mutationen im OXCT1-Gen können Scot-S-Mangel und dieser eine Form der Ketoazidose hervorrufen. Mit körperlichem Training kann die Scot-Aktivität in Muskeln um ein Vielfaches gesteigert werden, insbesondere bei Diabetikern.[2][3]
Scot-S ist eines der Proteine, deren Tryptophan-Reste durch reaktive Sauerstoffspezies nitriert werden. In Ratten wurde nachgewiesen, dass sich so nitriertes Protein im Alter in Herzmuskeln ansammelt. Das modifizierte Enzym wies eine höhere Aktivität auf als das unveränderte.[4]
Katalysiertes Gleichgewicht
Acetoacetat + Succinyl-CoA ⇔ Acetoacetyl-CoA + Succinat
CoA wird auf Acetoacetat übertragen. Statt Acetessigsäure können viele andere γ-Ketosäuren als Substrat fungieren, die Reaktion ist dann aber verlangsamt. Statt Succinyl-CoA wird auch Malonyl-CoA akzeptiert. Das Zwischenprodukt ist ein instabiles Säureanhydrid, das mit dem Protein gebildet wird.[5][2]
Weblinks
- reactome.org: acetoacetate+succinyl-CoA ↔ acetoacetyl-CoA+succinate
- Orphanet: SCOT deficiency (engl.)
Einzelnachweise
- PROSITE documentation PDOC00980. Swiss Institute of Bioinformatics (SIB), abgerufen am 20. September 2011 (englisch).
- UniProt P55809
- El Midaoui A, Chiasson JL, Tancrède G, Nadeau A: Physical training reverses defect in 3-ketoacid CoA-transferase activity in skeletal muscle of diabetic rats. In: Am. J. Physiol. Endocrinol. Metab.. 288, Nr. 4, April 2005, S. E748–52. doi:10.1152/ajpendo.00515.2004. PMID 15774485.
- Bregere C, Rebrin I, Sohal RS: Detection and characterization of in vivo nitration and oxidation of tryptophan residues in proteins. In: Meth. Enzymol.. 441, 2008, S. 339–49. doi:10.1016/S0076-6879(08)01219-6. PMID 18554544.
- expasy: EC 2.8.3.5