3,4-Homotropiliden
3,4-Homotropiliden ist ein ungesättigter bicyclischer Kohlenwasserstoff, bei dem eine 1,4-Cycloheptadien-Einheit mit einem Cyclopropan-Ring anelliert ist.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
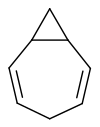 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | 3,4-Homotropiliden | ||||||||||||
| Andere Namen |
Bicyclo[5.1.0]octa-2,5-dien | ||||||||||||
| Summenformel | C8H10 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 106,16 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Darstellung
3,4-Homotropiliden erhält man durch Cyclopropanierung von Cycloheptatrien (Tropiliden). Nach einem Verfahren von Gaspar und Roth wird Tropiliden 1 in Gegenwart von Kupfer(I)-chlorid als Katalysator mit gasförmigem Diazomethan umgesetzt. Man erhält ein Gemisch von 3,4-Homotropiliden 2 und 1,2-Homotropiliden 3, das gaschromatographisch getrennt werden kann.[2]
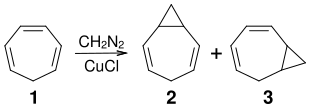
Eigenschaften
Thermische Umlagerung bei hoher Temperatur
Während sich 1,2-Homotropiliden bei 225 °C umlagert, ist das 3,4-Homotropiliden überraschend stabil. Erst bei einer Temperatur von 305 °C bildet sich Tetrahydropentalen:
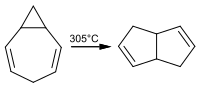
zu Tetrahydropentalen
Degenerierte Cope-Umlagerung
Die auffallendste Eigenschaft des 3,4-Homotropiliden zeigt sich bei der Temperaturabhängigkeit des NMR-Spektrums. Bei tiefer Temperatur (−50 °C) ist das Spektrum gut aufgelöst mit einer ausgeprägten Feinstruktur für die Signale der jeweils vier Cyclopropyl- und Vinyl-H-Atome, bzw. der beiden aliphatischen H-Atome. Beim Erwärmen auf Zimmertemperatur wird das Spektrum diffuser und von den zehn Wasserstoffatomen sind nur noch die Vinyl-Wasserstoffatome klar zuzuordnen. Bei 180 °C bildet sich schließlich ein neues Spektrum heraus, bei dem die Signale für die Vinyl-H-Atome nur noch die halbe Fläche einnehmen und die Cyclopropyl-H-Atom-Signale ganz verschwunden sind. Diese Beobachtung kann auf eine degenerierte Cope-Umlagerung zurückgeführt werden:

beim 3,4-Homotropiliden
Bei hoher Temperatur vertauschen die Wasserstoffatome ihren Platz so schnell, dass man in NMR-Spektrum die Mittelwerte der Signale beobachtet. Für dieses Verhalten wurde der Begriff „fluktuierende Struktur“ geprägt.
3,4-Homotropiliden kann sowohl eine transoide Konformation (1) als auch eine cisoide Konformation (2)einnehmen. Die transoide Konformation ist thermodynamisch begünstigt, jedoch wesentlich ungünstiger für die Cope-Umlagerung, verglichen mit der cisoiden Konformation. Der Cope-Umlagerung (B) beim 3,4-Homotropiliden ist daher eine Konformationsumkehr (A) von der cis- in die trans-Konformation vorgelagert. Nach der Cope-Umlagerung liegt das Molekül wieder in der cis-Konformation vor und steht erneut im Gleichgewicht mit der trans-Konformation:
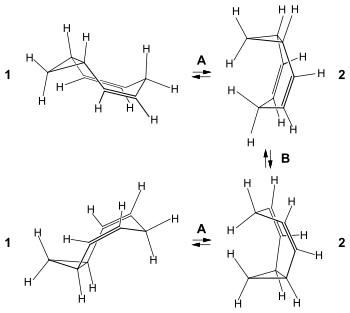
A: Gleichgewicht zwischen trans-Konformation 1 und cis-Konformation 2
B: degenerierte Cope-Umlagerung.
Man kann abschätzen, dass ein 3,4-Homotropiliden-Molekül bei 180 °C etwa tausendmal in der Sekunde eine Cope-Umlagerung eingeht und bei −50 °C etwa einmal pro Sekunde.[3]
Verbindungen mit 3,8-Homotropiliden-Strukturelement
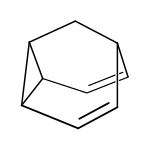
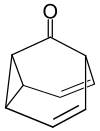
Wird die cis-Konformation der 3,4-Homotropiliden-Struktur durch den Einbau einer Brücke zwischen der Cyclopropyl- und der aliphatischen Position erzwungen, so verläuft auch die Cope-Umlagerung deutlich schneller. Beispiele für weitere Verbindungen mit einer fluktuierenden Struktur sind das Barbaralan, Barbaralon und das Semibullvalen:[4]
 |
 |
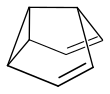 |
| Barbaralan | Barbaralon | Semibullvalen |
Wird das 3,4-Homotropiliden mit einer weiteren Doppelverbindung überbrückt, so erhält man das Bullvalen, ein hochsymmetrisches Molekül mit drei 3,4-Homotropiliden-Einheiten. Durch aufeinanderfolgende degenerierte Cope-Umlagerungen ergeben sich rund 1,2 Millionen Valenzisomere, bei denen jedes der zehn Kohlenstoffatome jede beliebige Position im Molekül einnehmen und mit jedem anderen Kohlenstoffatom verknüpft sein kann:[3]
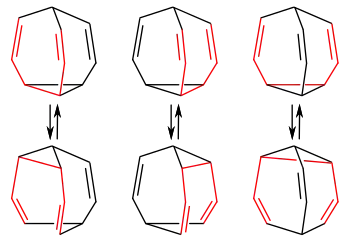
und mit den jeweiligen Valenzisomeren der entsprechenden Cope-Umlagerung
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- W. von E. Doering, W. R. Roth: A rapidly reversible degenerate cope rearrangement. In: Tetrahedron. Band 19, Nr. 5, Januar 1963, S. 715, doi:10.1016/S0040-4020(01)99207-5.
- W. V. E. Doering, W. R. Roth: Thermische Umlagerungsreaktionen. In: Angewandte Chemie. Band 75, Nr. 1, 7. Januar 1963, S. 27, doi:10.1002/ange.19630750106.
- Sebastian Ehrhart, Martin Empting, Dominik Ruppert: Barbaralon. (PDF) Abgerufen am 1. Oktober 2019.