20-Hydroxyeicosatetraensäure
20-Hydroxyeicosatetraensäure, auch bekannt als 20-HETE, ist ein Metabolit der Arachidonsäure mit einem breiten Wirkspektrum, vor allem auf das Herz-Kreislauf-System und die Nieren. In physiologischer Weise ist 20-HETE an der Regulation des Blutdrucks und der Organdurchblutung beteiligt. Präklinische Studien legen eine Rolle von 20-HETE bei der Pathogenese von Herzinfarkten und Schlaganfällen nahe. Ein Verlust der Synthesefähigkeit von 20-HETE ist mit dem Auftreten der hereditären spastischen Paraplegien (HSP) assoziiert. Eine Überproduktion von 20-HETE kann zur Entstehung von Tumoren beitragen, insbesondere zu Mamma-Karzinomen.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
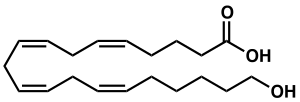 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | (5Z,8Z,11Z,14Z)-20-Hydroxyeicosa-5,8,11,14-tetraensäure | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C20H32O3 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 320,47 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Biosynthese
Produktion beim Menschen
20-HETE wird durch Cytochrom-P450-ω-Hydroxylasen (CYP450) aus Arachidonsäure synthetisiert.[2] Hierbei sind in den meisten Geweben die Subtypen CYP4A und CYP4F für diese Reaktion verantwortlich. In kleinen Mengen entsteht durch diese Enzyme auch die verwandte 19-HETE.[2] Außerdem sind die Subtypen CYP2U1 und CYP4F8 in der Lage, die beiden Formen ineinander umzuwandeln.[3][4] Je nach Gewebe unterscheidet sich die Ausstattung mit den jeweiligen Enzymen jedoch zum Teil erheblich.
Das Enantiomer 19(R)-HETE ist in der Lage, die Wirkung von 20-HETE auf das Herz-Kreislauf-System zu antagonisieren.[5]
Viele der beteiligten Enzyme sind in der Lage, ebenfalls kürzer- oder längerkettige Fettsäuren zu hydroxylieren. Damit sind sie auch für die Bildung verschiedener Prostaglandine und Leukotriene wichtig, die zusammen mit 20-HETE Entzündungsvorgänge induzieren und modulieren können.
Produktion bei Nagetieren und anderen Tieren
Bei Mäusen werden 19-HETE und 20-HETE durch die beiden miteinander verwandten Enzyme CYP4A12A und CYP4A12B synthetisiert; die Isoform CYP4A12A ist in der männlichen Niere Androgen-abhängig aktiv.[6] Bei Ratten sind dafür die Enzyme CYP4A1, CYP4A2, CYP4A3 und CYP4A8 verantwortlich.[7] Die Verteilung der Enzyme in den einzelnen Geweben weicht allerdings stark von der beim Menschen ab, sodass vergleichende Studien schwierig sind.[8]
Die Enzyme CYP2J9 (bei Mäusen), CYP2J3 (bei Ratten) und CYP2J (bei Schafen) metabolisieren Arachidonsäure in erster Linie zu 19-HETE. Die Cytochrome vom Typ CYP2J können außerdem 18-HETE bilden.
Regulation der Biosynthese
Die Biosynthese von 20-HETE kann durch eine Reihe von Faktoren gesteigert werden. Besonders hervorzuheben sind hierbei Androgene, Angiotensin II, Endotheline und Noradrenalin.[9][10][11] Pharmakologisch ist bei Gabe von COX-2-Hemmern wie NSARs, Opioiden und Furosemid zu beachten, dass dadurch die Biosynthese von 20-HETE gesteigert werden kann.[12][13]
Gehemmt wird die Biosynthese durch Stickstoffmonoxid, Kohlenstoffmonoxid und Superoxid-Anionen. Diese physiologischen Inhibitoren wirken über eine Bindung an das Häm in den Cytochromen.[12] Auf pharmakologischer Seite lässt sich die 20-HETE-Synthese durch Arachidonsäure-Analoga hemmen.[14][15]
Verbreitung der Enzyme
20-HETE-bildende Enzyme kommen beim Menschen in Leber, Niere, Gehirn, Lunge und Darm sehr häufig vor.[2] In Blutgefäßen beschränkt sich die Aktivität auf die glatte Gefäßmuskulatur, während das Endothel fast keine 20-HETE bildet.[7] Außerdem kann 20-HETE von Blutzellen wie neutrophilen Granulozyten und Thrombozyten gebildet werden.[16][17]
Metabolismus
Der wichtigste Weg zum Abbau von 20-HETE ist die Konjugation mit aktivierter Glucuronsäure im Rahmen der Biotransformation.[18] Darüber hinaus sind viele weitere Abbauwege bekannt, bei denen teilweise wiederum selbst biologisch aktive Metabolite wie Prostaglandine und Leukotriene entstehen.
Effekte bei Nagetieren
Verengung der Blutgefäße
In verschiedenen Nagetiermodellen konnte gezeigt werden, dass 20-HETE in niedrigen Konzentrationen (unter 50 nmol/l) Arterien konstringieren kann. Dieser Mechanismus funktioniert über die Sensitivierung der glatten Muskelzellen für gefäßverengende Substanzen wie alpha-adrenerge Agonisten,[19] Vasopressin,[20] Endothelin und Angiotensin II.[7]
20-HETE interagiert in komplexer Weise mit dem RAAS: Angiotensin II stimuliert in den präglomerulären Kapillaren der Niere die Produktion von 20-HETE. Diese Produktion wird benötigt, damit Angiotensin II seine volle vasokonstriktorische Wirkung entfalten kann. 20-HETE induziert außerdem die Transkription des Angiotensin-konvertierendes Enzym (ACE). Andere Substanzen wie Androgene[9][10] und Noradrenalin[11] stimulieren die 20-HETE Produktion ebenfalls und haben vasokonstriktorische Wirkung, die durch 20-HETE verstärkt wird.
In einem anderen Mausmodell konnte 20-HETE Kalzium-abhängige Kaliumkanäle blockieren. Dadurch wird der Kalziumeinstrom in glatten Muskelzellen durch L-Typ-Ca2+-Kanäle gefördert, was die Muskelkontraktion und damit die Vasokonstriktion verstärkt.[21]
Bei Ratten konnte gezeigt werden, dass 20-HETE in Endothelzellen die Assoziation der NO-Synthase (eNOS) mit dem Chaperon Hsp90 inhibiert. Dadurch kann die eNOS nicht aktiviert werden. So können die Zellen kein vasodilatierendes NO synthetisieren und potentiell schädliche Superoxid-Anionen können sich im Zytosol anreichern.[7][22][23]
20-HETE kann Arterien ebenfalls direkt über die Aktivierung des Thromboxan-A2-Rezeptors verengen (weiteres dazu im Abschnitt Gefäßtonus).
Diese vasokonstriktorischen Effekte können den Blutfluss in spezifischen Teilen des Körpers vermindern. Bei systemischer Wirkung kann 20-HETE damit den Blutdruck erhöhen.[11][21][24][25]
Verletzung von Blutgefäßen
Ratten, bei denen die Arteria carotis communis selektiv geschädigt wurde, zeigten im Anschluss erhöhte Aktivität von CYP4A und infolgedessen auch erhöhte Spiegel von 20-HETE im betroffenen Gewebe. Die Inhibition der 20-HETE-produzierenden Enzyme konnte die Intimaproliferation und die Umstrukturierung der Gefäßstruktur am geschädigten Endothel deutlich vermindern. Diese Effekte legen nahe, dass 20-HETE physiologischerweise an der Heilung von Gefäßverletzungen beteiligt ist.[26]
Thrombosen
Im C57BL/6-Mausmodell wurde gezeigt, dass 20-HETE die Entwicklung von Thrombosen in der Arteria carotis communis und der Arteria femoralis beschleunigen kann und dabei den Blutfluss durch die betroffenen Gefäße reduziert. Studien an menschlichen Zellen aus Umbilikalvenen zeigen, dass 20-HETE als extrazellulärer Aktivator von Kinasekaskaden wirken kann, die die Freisetzung des Thrombose-fördernden Von-Willebrand-Faktors erhöhen.[27]
Renale Absorption
Im Tiermodell kann 20-HETE die Proteinkinase C (PKC) in den Epithelzellen des Nierentubulus aktivieren. Die aktivierte PKC phosphoryliert und hemmt die Natrium-Kalium-ATPase und blockiert außerdem den Natrium-Kalium-Chlorid-Symporter (NKCC) und einen Kaliumkanal in der aufsteigenden Henle-Schleife. Dadurch wird die Resorption von Natrium und Wasser im Nephron reduziert und damit der Blutdruck gesenkt.[21]
Bluthochdruck
Wie oben bereits beschrieben kann 20-HETE den Blutdruck sowohl steigern als auch senken. Die Effekte von 20-HETE sind komplex, wie die nachfolgenden Studien am Tiermodell zeigen. Viele der Modelle scheinen ähnliche Effekte wie beim Menschen auszulösen. So haben zum Beispiel Männer öfter Bluthochdruck als Frauen; dieses Verhältnis ändert sich jedoch bei der Betrachtung von Frauen nach der Menopause mit relativ gesehen höheren Androgenspiegeln.[9]
Spontaner Bluthochdruck
Spontan hypertensive Ratten zeigen erhöhte Spiegel von CYTP4A2 und 20-HETE. Bei Blockade der 20-HETE-Produktion konnte der Blutdruck vor allem bei weiblichen Tieren nach der Menopause deutlich gesenkt werden.[28][29][30]
Salz-sensitiver Bluthochdruck
Salz-sensitive Ratten entwickeln bei hoher Salzaufnahme sehr schnell eine arterielle Hypertonie, die durch die Reduktion des Salzkonsums sehr gut behandelt werden kann. In diesem Modell zeigen Ratten einen hochregulierten CYP4A/20-HETE-Stoffwechsel im zerebralen Gefäßsystem und eine gesteigerte Produktion von reaktiven Sauerstoffspezies (ROS) in den Endothelzellen, die wiederum den CYP4A/20-HETE-Stoffwechsel stimulieren. Die Inhibition von CYP4A und der 20-HETE-Produktion kann den Blutdruck senken.[31] Der Bluthochdruck in diesem Modell tritt bei männlichen Ratten gehäuft auf und scheint durch Vasopressin und das RAAS beeinflusst zu werden.[32][33]
In einem anderen Modell konnte gezeigt werden, dass die Wirkung von 20-HETE auf den Blutdruck nicht nur vom betroffenen Organ, sondern auch von den einzelnen Gebieten eines Organs abhängt: Während in der Nierenrinde die 20-HETE-Produktion durch einen Inhibitor nicht gesenkt werden konnte und der Blutdruck dadurch anstieg, wirkte derselbe Inhibitor im Nierenmark.[34]
Androgen-induzierter Bluthochdruck
Die Gabe von Androgenen verursacht bei männlichen und weiblichen Ratten Bluthochdruck. Dieser Druckanstieg kann durch Inhibitoren von CYP4A und anderen 20-HETE-synthetisierenden Enzymen deutlich reduziert werden.[9]
Gentechnisch-bedingter Bluthochdruck
Transgene Mäuse mit einer Überexpression von CYP4A12 entwickeln einen Androgen-unabhängigen Bluthochdruck, der mit erhöhten 20-HETE-Spiegeln assoziiert ist. Dieser kann durch einen CYP4A-selektiven Inhibitor vollständig behandelt werden.[35] Männliche Mäuse, die das CYP4A14 durch Gen-Knockout nicht exprimieren, entwickeln eine Androgen-abhängige Hypertonie. Dieses scheinbar paradoxe Ergebnis ist auf die reaktive Überexpression von CYP4A12A zu erklären. Der Knockout des CYP4A14, das keine 20-HETE produziert, führt zu einer gesteigerten Expression des 20-HETE-produzierenden CYP4A149 und daraus folgender Überproduktion von 20-HETE. Bei diesem Versuch konnten außerdem Indizien dafür gewonnen werden, dass der gesteigerte Blutdruck unter anderem durch den vermehrten Einbau des Natrium-Protonen-Antiports 3 in der Niere verursacht wird.[6][36][37][38] Ergebnisse aus den CYP4A12-transgenen Mäusen unterstützen diese These.[6]
Mäuse ohne CYP4A10 haben bei einer salzarmen Diät normale Blutdrücke, bei normalem oder gesteigertem Salzkonsum jedoch Bluthochdruck. Dieser Effekte beruht auf einem renalen Mangel an CYP2C44 infolge des Verlusts von CYP4A10. CYP2C44 metabolisiert Arachidonsäure zu einer Reihe vasodilatativ-wirkender Substanzen. Der gesteigerte Blutdruck kann durch eine Aktivierung von CYP2C44 wirkungsvoll behandelt werden.[6][39]
Effekte beim Menschen
CYP4A11-Polymorphismus
Das humane CYP4A11 stimmt in seiner Aminosäuresequenz zu großen Teilen mit zwei Cytochromen bei Mäusen überein. Daher liegt die Vermutung nahe, dass auch die Funktion beim Menschen zumindest ähnlich ist.[40] Beispielsweise sorgt ein Defekt im menschlichen CYP4A11 für Bluthochdruck, genauso wie ein Defekt im murinen CYP4A14.
Bei einer Variante des Gens von CYP4A11 ist an Stelle 8590 ein Thymidin durch ein Cytosin ersetzt. Das führt im Protein zu einem Aminosäureaustausch, der die Enzymaktivität von CYP4A11 im Bezug auf die Produktion von 20-HETE vermindert, was mit arterieller Hypertonie in Zusammenhang gebracht werden konnte.[41][42][43] Auch eine Mutation in der Promotorregion von CYTP4A11, die mit verminderter Transkription einhergeht, ist mit Bluthochdruck assoziiert.[44] Außerdem konnte bei einer weiteren Mutation ein erhöhtes Risiko für Schlaganfälle nachgewiesen werden.[45]
CYP4F2-Polymorphismus
Auch beim CYP4F2 konnte eine Mutation nachgewiesen werden, die mit verminderter 20-HETE-Syntheseaktivität und vor allem bei Männern mit erhöhtem Blutdruck einhergeht.[46][47][48] Ebenfalls konnte eine erhöhte Rate an Schlaganfällen und Herzinfarkten nachgewiesen werden.[49][48] Eine Mutation in einem Intron konnte ebenfalls mit Bluthochdruck in Verbindung gebracht werden.
CYP2U1-Mutationen
Eine Mutation (c.947A>T) im CYP2U1 konnte bei einer kleinen Patientengruppe mit dem Auftreten von hereditären spastischen Paraplegien (HSP) in Verbindung gebracht werden. Die Mutation verursacht einen Aminosäureaustausch im aktiven Zentrum des Enzyms (Asp>Val). Der Aminosäureaustausch kann damit zu einer Dysfunktion der Mitochondrien führen.[50][51] Eine weitere Mutation im CYP2U1 (c.1A>C/p.Met1?) liegt bei unter einem Prozent der HSP-Patienten vor.[52] Obwohl die Rolle von 20-HETE bei diesen Mutationen nicht belegt ist, könnte die reduzierte Produktion von 20-HETE und die damit einhergehende verminderte Aktivierung des TRPV1-Rezeptors im Nervengewebe zur Krankheit beitragen.[50]
Brustkrebs
Zwei menschliche Brustkrebs-Zelllinien wurden gentechnisch zur Überexpression von CYP4Z1 und VEGF induziert. Durch die vermehrte Synthese von CYP4Z1 wurde auch 20-HETE vermehrt produziert. Wenn diese Zellen in ein Mausmodell transplantiert werden, zeigt sich ein deutlich gesteigertes Tumorwachstum im Vergleich zu normalen 20-HETE-Spiegeln.[53] Bei Gabe von Isoliquiritigenin, einem Medikament zur Krebsbehandlung, das Apoptose auslösen kann, konnte neben anderen Effekten gezeigt werden, dass die Produktion von 20-HETE abnimmt. Wenn man diesen Zellen zusätzlich 20-HETE zusetzt, kann die Apoptose verhindert werden.[54][55] Durch Isoliquiritigenin kann auch die Metastasierung von Tumoren gehemmt werden. Dieser Mechanismus beruht ebenfalls auf einer Reduktion der 20-HETE-Produktion.[55] Auch die durch VEGF und andere Stoffe induzierte Vaskularisierung des Tumorgewebes kann durch die Hemmung der 20-HETE-Synthese vermindert werden.[56]
Im 3′-untranslatierten Bereich der mRNAs von CYP4Z1 und dem Pseudogen CYP4Z2P finden sich viele gleiche miRNA-Bindungstellen. Durch Bindung von spezifischen miRNAs kann die Translation von CYP4Z1 gehemmt werden. Bei Expression von CYP4Z2P binden die miRNAs an diese mRNA und CYP4Z1 und damit 20-HETE kann wieder gebildet werden. Außerdem stimulieren die miRNAs in Brustkrebszellen über den MAPK/ERK-Signalweg die Produktion von VEGF und damit die Vaskularisierung des Tumorgewebes.[57]
In Brustkrebsgewebe werden die Cytochrome CYP4Z2,[58][57] CYP4A11, CYP4A22, CYP4F2 und CYP4F3 vermehrt exprimiert.[59] Da diese Enzyme 20-HETE synthetisieren scheint ein Zusammenhang zwischen der 20-HETE-Produktion und dem Auftreten von Brustkrebs zu bestehen.
Andere Krebsarten
20-HETE stimuliert das Wachstum von menschlichen Gliomen. Wenn diese Zellen gentechnisch so verändert werden, dass sie CYP4Z1 überexprimieren, so steigert sich die Syntheserate von 20-HETE, was zu einem rapiden Wachstum führt. Dieser Effekt kann durch die Inhibition der 20-HETE-Produktion verhindert werden. Ähnliche Effekte konnten beim nicht-kleinzelligen Lungenkrebs gefunden werden.[60] Ein selektiver Inhibitor der 20-HETE-Produktion und ein Antagonist von 20-HETE konnten das Wachstum von Nierentumoren in zwei Zelllinien vermindern.[61]
In Ovar-, Kolon-, Schilddrüsen- und Lungenkarzinomen wurde eine vermehrte Expression der mRNA von CYP4A11, CYP4A22, CYP4F2 und/oder CYP4F3 nachgewiesen. Diese ist mit einem erhöhten Spiegel von CYP4F2 und damit der vermehrten Synthese von 20-HETE aus Arachidonsäure assoziiert.[59][62] Ovarial-Karzinome exprimieren außerdem vermehrt mRNA für CYP4Z1, was mit einer schlechteren Prognose in Verbindung steht.[63][64][65]
Während diese Studien darauf hindeuten, dass CYP4A11, CYP4A22, CYP4F2 und/oder CYP4F3 20-HETE produzieren, was wiederum das Wachstum der genannten Krebserkrankungen in Modellsystemen fördert und dies daher auch bei menschlichen Krebsarten tun kann, bedarf diese Erkenntnis eindeutig weiterer Untersuchungen. Zum Beispiel blockiert ein Inhibitor der 20-HETE-Produktion das Wachstum von Gliomzellen des menschlichen Gehirns in Kultur. Da für diese Zellen jedoch nicht gezeigt werden konnte, dass sie 20-HETE produzieren, wird angenommen, dass ein anderer Metabolit für die Aufrechterhaltung des Zellwachstums verantwortlich ist.[66] Auch bisher unbekannte Nebenwirkungen des Inhibitors könnten für diese Effekte verantwortlich sein.
Thrombozyten-Aggregation
20-HETE inhibiert die Aggregation von Thrombozyten durch direkte Konkurrenz um die Enzyme, die Arachidonsäure in Prostaglandine und Leukotriene umwandeln (kompetitiver Inhibitor). Außerdem metabolisieren die Thrombozyten 20-HETE zu 20-Hydroxyl-Analoga von Prostaglandin H2 und Thromboxan A2, die fast vollständig inaktiv sind, aber die Synthese der eigentlichen Arachidonsäure-Derivate hemmen. Des Weiteren blockiert 20-HETE die Rezeptoren für Thromboxan A2 kompetitiv, sodass auch hier nur eine verminderte Wirkung eintreten kann.[67] Durch diese drei Effekte sorgen für die aggregrationshemmende Wirkung von 20-HETE. Damit diese Effekt jedoch voll zum Tragen kommen sind allerdings Konzentrationen erforderlich, die weit über den physiologischen Spiegeln liegen. Daher sind diese Effekte eher pharmakologischer Natur.
Gefäßtonus
20-HETE kann Arteriolen über Bindung an den Thromboxan-A2-Rezeptor direkt konstringieren. Hierbei konnte ebenfalls nachgewiesen werden, dass die Produktion von 20-HETE durch erhöhten Blutfluss induziert werden kann.[24][25] Daher wird vermutet, dass 20-HETE eine Rolle bei der Autoregulation der Durchblutung spielt, die besonders in den Nieren und im Gehirn ausgeprägt ist.
Metabolisches Syndrom
Eine Studie mit 30 Personen, die unter dem metabolischen Syndrom leiden, konnte signifikant erhöhte Plasma- und Urinspiegel von 20-HETE im Vergleich zur Kontrollgruppe nachweisen.[68]
Weiteres
Bei Mäusen und Menschen konnte gezeigt werden, dass 20-HETE den Kationenkanal TRPV1 (Transient Receptor Potential, Unterfamilie V, Subtyp 1 bzw. Vanilloid-Rezeptor 1) aktivieren kann.[69] Dieser steht im Zusammenhang mit Schmerz- und Hitzewahrnehmung.
Einzelnachweise
- Datenblatt 20- Hydroxy- (5Z,8Z,11Z,14Z) - eicosatetraenoic acid, ~100 μg/mL in ethanol, ≥90% (HPLC) bei Sigma-Aldrich, abgerufen am 17. August 2018 (PDF).
- Kroetz DL, Xu F: Regulation and inhibition of arachidonic acid omega-hydroxylases and 20-HETE formation. In: Annual Review of Pharmacology and Toxicology. 45, 2005, S. 413–38. doi:10.1146/annurev.pharmtox.45.120403.100045. PMID 15822183.
- S. S. Chuang, C Helvig, M Taimi, H. A. Ramshaw, A. H. Collop, M Amad, J. A. White, M Petkovich, G Jones, B Korczak: CYP2U1, a novel human thymus- and brain-specific cytochrome P450, catalyzes omega- and (omega-1)-hydroxylation of fatty acids. In: Journal of Biological Chemistry. 279, Nr. 8, 2004, S. 6305–14. doi:10.1074/jbc.M311830200. PMID 14660610.
- J. P. Hardwick: Cytochrome P450 omega hydroxylase (CYP4) function in fatty acid metabolism and metabolic diseases. In: Biochemical Pharmacology. 75, Nr. 12, 2008, S. 2263–75. doi:10.1016/j.bcp.2008.03.004. PMID 18433732.
- J. Cheng, J. S. Ou, H Singh, J. R. Falck, D Narsimhaswamy, K. A. Pritchard Jr, M. L. Schwartzman: 20-hydroxyeicosatetraenoic acid causes endothelial dysfunction via eNOS uncoupling. In: AJP: Heart and Circulatory Physiology. 294, Nr. 2, 2008, S. H1018–26. doi:10.1152/ajpheart.01172.2007. PMID 18156192.
- J. H. Capdevila, W Wang, J. R. Falck: Arachidonic acid monooxygenase: Genetic and biochemical approaches to physiological/pathophysiological relevance. In: Prostaglandins & Other Lipid Mediators. 120, 2015, S. 40–9. doi:10.1016/j.prostaglandins.2015.05.004. PMID 25986599. PMC 4575609 (freier Volltext).
- Hoopes SL, Garcia V, Edin ML, Schwartzman ML, Zeldin DC: Vascular actions of 20-HETE. In: Prostaglandins & Other Lipid Mediators. 120, Juli 2015, S. 9–16. doi:10.1016/j.prostaglandins.2015.03.002. PMID 25813407. PMC 4575602 (freier Volltext).
- C. C. Wu, T Gupta, V Garcia, Y Ding, M. L. Schwartzman: 20-HETE and blood pressure regulation: Clinical implications. In: Cardiology in Review. 22, Nr. 1, 2014, S. 1–12. doi:10.1097/CRD.0b013e3182961659. PMID 23584425. PMC 4292790 (freier Volltext).
- C. C. Wu, M. L. Schwartzman: The role of 20-HETE in androgen-mediated hypertension. In: Prostaglandins & Other Lipid Mediators. 96, Nr. 1–4, 2011, S. 45–53. doi:10.1016/j.prostaglandins.2011.06.006. PMID 21722750. PMC 3248593 (freier Volltext).
- V Garcia, J Cheng, A Weidenhammer, Y Ding, C. C. Wu, F Zhang, K Gotlinger, J. R. Falck, M. L. Schwartzman: Androgen-induced hypertension in angiotensinogen deficient mice: Role of 20-HETE and EETS. In: Prostaglandins & Other Lipid Mediators. 116–117, 2015, S. 124–30. doi:10.1016/j.prostaglandins.2014.12.001. PMID 25526688. PMC 4385421 (freier Volltext).
- N Miyata, R. J. Roman: Role of 20-hydroxyeicosatetraenoic acid (20-HETE) in vascular system. In: Journal of smooth muscle research = Nihon Heikatsukin Gakkai kikanshi. 41, Nr. 4, 2005, S. 175–93. doi:10.1540/jsmr.41.175. PMID 16258232.
- F Fan, Y Muroya, R. J. Roman: Cytochrome P450 eicosanoids in hypertension and renal disease. In: Current Opinion in Nephrology and Hypertension. 24, Nr. 1, 2015, S. 37–46. doi:10.1097/MNH.0000000000000088. PMID 25427230. PMC 4260681 (freier Volltext).
- K. M. Knights, A Rowland, J. O. Miners: Renal drug metabolism in humans: The potential for drug-endobiotic interactions involving cytochrome P450 (CYP) and UDP-glucuronosyltransferase (UGT). In: British Journal of Clinical Pharmacology. 76, Nr. 4, 2013, S. 587–602. doi:10.1111/bcp.12086. PMID 23362865. PMC 3791982 (freier Volltext).
- K. Z. Edson, A. E. Rettie: CYP4 enzymes as potential drug targets: Focus on enzyme multiplicity, inducers and inhibitors, and therapeutic modulation of 20-hydroxyeicosatetraenoic acid (20-HETE) synthase and fatty acid ω-hydroxylase activities. In: Current Topics in Medicinal Chemistry. 13, Nr. 12, 2013, S. 1429–40. doi:10.2174/15680266113139990110. PMID 23688133. PMC 4245146 (freier Volltext).
- D. L. Kroetz, F Xu: Regulation and inhibition of arachidonic acid omega-hydroxylases and 20-HETE formation. In: Annual Review of Pharmacology and Toxicology. 45, 2005, S. 413–38. doi:10.1146/annurev.pharmtox.45.120403.100045. PMID 15822183.
- Hill E, Murphy RC: Quantitation of 20-hydroxy-5,8,11,14-eicosatetraenoic acid (20-HETE) produced by human polymorphonuclear leukocytes using electron capture ionization gas chromatography/mass spectrometry. In: Biological Mass Spectrometry. 21, Nr. 5, Mai 1992, S. 249–53. doi:10.1002/bms.1200210505. PMID 1525186.
- Tsai IJ, Croft KD, Puddey IB, Beilin LJ, Barden A: 20-Hydroxyeicosatetraenoic acid synthesis is increased in human neutrophils and platelets by angiotensin II and endothelin-1. In: American Journal of Physiology. Heart and Circulatory Physiology. 300, Nr. 4, April 2011, S. H1194–200. doi:10.1152/ajpheart.00733.2010. PMID 21239640.
- Y. B. Jarrar, E. Y. Cha, K. A. Seo, J. L. Ghim, H. J. Kim, D. H. Kim, S. J. Lee, J. G. Shin: Determination of major UDP-glucuronosyltransferase enzymes and their genotypes responsible for 20-HETE glucuronidation. In: The Journal of Lipid Research. 55, Nr. 11, 2014, S. 2334–42. doi:10.1194/jlr.M051169. PMID 25249502. PMC 4617135 (freier Volltext).
- F Zhang, M. H. Wang, J. S. Wang, B Zand, V. R. Gopal, J. R. Falck, M Laniado-Schwartzman, A Nasjletti: Transfection of CYP4A1 cDNA decreases diameter and increases responsiveness of gracilis muscle arterioles to constrictor stimuli. In: AJP: Heart and Circulatory Physiology. 287, Nr. 3, 2004, S. H1089–95. doi:10.1152/ajpheart.00627.2003. PMID 15130884.
- J Kaide, F Zhang, Y Wei, W Wang, V. R. Gopal, J. R. Falck, M Laniado-Schwartzman, A Nasjletti: Vascular CO counterbalances the sensitizing influence of 20-HETE on agonist-induced vasoconstriction. In: Hypertension. 44, Nr. 2, 2004, S. 210–6. doi:10.1161/01.HYP.0000135658.57547.bb. PMID 15226275.
- K. Z. Edson, A. E. Rettie: CYP4 enzymes as potential drug targets: Focus on enzyme multiplicity, inducers and inhibitors, and therapeutic modulation of 20-hydroxyeicosatetraenoic acid (20-HETE) synthase and fatty acid ω-hydroxylase activities. In: Current Topics in Medicinal Chemistry. 13, Nr. 12, 2013, S. 1429–40. doi:10.2174/15680266113139990110. PMID 23688133. PMC 4245146 (freier Volltext).
- J Cheng, J. S. Ou, H Singh, J. R. Falck, D Narsimhaswamy, K. A. Pritchard Jr, M. L. Schwartzman: 20-hydroxyeicosatetraenoic acid causes endothelial dysfunction via eNOS uncoupling. In: AJP: Heart and Circulatory Physiology. 294, Nr. 2, 2008, S. H1018–26. doi:10.1152/ajpheart.01172.2007. PMID 18156192.
- Wiest EF, Walsh-Wilcox MT, Rothe M, Schunck WH, Walker MK: Dietary Omega-3 Polyunsaturated Fatty Acids Prevent Vascular Dysfunction and Attenuate Cytochrome P4501A1 Expression by 2,3,7,8-Tetrachlorodibenzo-P-Dioxin. In: Toxicological Sciences : an Official Journal of the Society of Toxicology. 154, Nr. 1, 2016, S. 43–54. doi:10.1093/toxsci/kfw145. PMID 27492226. PMC 5091366 (freier Volltext).
- Toth P, Rozsa B, Springo Z, Doczi T, Koller A: Isolated human and rat cerebral arteries constrict to increases in flow: role of 20-HETE and TP receptors. In: Journal of Cerebral Blood Flow and Metabolism : Official Journal of the International Society of Cerebral Blood Flow and Metabolism. 31, Nr. 10, 2011, S. 2096–105. doi:10.1038/jcbfm.2011.74. PMID 21610722. PMC 3208155 (freier Volltext).
- Capra V, Bäck M, Angiolillo DJ, Cattaneo M, Sakariassen KS: Impact of vascular thromboxane prostanoid receptor activation on hemostasis, thrombosis, oxidative stress, and inflammation. In: Journal of Thrombosis and Haemostasis : JTH. 12, Nr. 2, 2014, S. 126–37. doi:10.1111/jth.12472. PMID 24298905.
- L. D. Orozco, H Liu, E Perkins, D. A. Johnson, B. B. Chen, F Fan, R. C. Baker, R. J. Roman: 20-Hydroxyeicosatetraenoic acid inhibition attenuates balloon injury-induced neointima formation and vascular remodeling in rat carotid arteries. In: Journal of Pharmacology and Experimental Therapeutics. 346, Nr. 1, 2013, S. 67–74. doi:10.1124/jpet.113.203844. PMID 23658377. PMC 3684845 (freier Volltext).
- J Wang, H Li, J He, B Li, Q Bao, X Zhang, Z Lv, Y Zhang, J Han, D Ai, Y Zhu: 20-Hydroxyeicosatetraenoic acid involved in endothelial activation and thrombosis. In: American Journal of Physiology. Heart and Circulatory Physiology. 308, Nr. 11, 2015, S. H1359–67. doi:10.1152/ajpheart.00802.2014. PMID 25820395.
- F Fan, Y Muroya, R. J. Roman: Cytochrome P450 eicosanoids in hypertension and renal disease. In: Current Opinion in Nephrology and Hypertension. 24, Nr. 1, 2015, S. 37–46. doi:10.1097/MNH.0000000000000088. PMID 25427230. PMC 4260681 (freier Volltext).
- L. L. Yanes, R Lima, M Moulana, D. G. Romero, K Yuan, M. J. Ryan, R Baker, H Zhang, F Fan, D. D. Davis, R. J. Roman, J. F. Reckelhoff: Postmenopausal hypertension: Role of 20-HETE. In: AJP: Regulatory, Integrative and Comparative Physiology. 300, Nr. 6, 2011, S. R1543–8. doi:10.1152/ajpregu.00387.2010. PMID 21474427. PMC 3119152 (freier Volltext).
- R Lima, L. L. Yanes, D. D. Davis, J. F. Reckelhoff: Roles played by 20-HETE, angiotensin II and endothelin in mediating the hypertension in aging female spontaneously hypertensive rats. In: AJP: Regulatory, Integrative and Comparative Physiology. 304, Nr. 3, 2013, S. R248–51. doi:10.1152/ajpregu.00380.2012. PMID 23220478. PMC 3567350 (freier Volltext).
- K. M. Lukaszewicz, J. H. Lombard: Role of the CYP4A/20-HETE pathway in vascular dysfunction of the Dahl salt-sensitive rat. In: Clinical Science. 124, Nr. 12, 2013, S. 695–700. doi:10.1042/CS20120483. PMID 23438293. PMC 4106241 (freier Volltext).
- L. L. Yanes, J. C. Sartori-Valinotti, R Iliescu, D. G. Romero, L. C. Racusen, H Zhang, J. F. Reckelhoff: Testosterone-dependent hypertension and upregulation of intrarenal angiotensinogen in Dahl salt-sensitive rats. In: AJP: Renal Physiology. 296, Nr. 4, 2009, S. F771–9. doi:10.1152/ajprenal.90389.2008. PMID 19211690. PMC 2670635 (freier Volltext).
- D. E. Stec, D. L. Mattson, R. J. Roman: Inhibition of renal outer medullary 20-HETE production produces hypertension in Lewis rats. In: Hypertension. 29, Nr. 1 Pt 2, 1997, S. 315–9. doi:10.1161/01.HYP.29.1.315. PMID 9039121.
- C. C. Wu, S. Mei, J. Cheng, Y. Ding, A. Weidenhammer, V. Garcia, F. Zhang, K. Gotlinger, V. L. Manthati, J. R. Falck, J. H. Capdevila, M. L. Schwartzman: Androgen-sensitive hypertension associates with upregulated vascular CYP4A12-20-HETE synthase. In: Journal of the American Society of Nephrology. 24, Nr. 8, 2013, S. 1288–96. doi:10.1681/ASN.2012070714. PMID 23641057. PMC 3736709 (freier Volltext).
- V. R. Holla, F Adas, J. D. Imig, X Zhao, E Price Jr, N Olsen, W. J. Kovacs, M. A. Magnuson, D. S. Keeney, M. D. Breyer, J. R. Falck, M. R. Waterman, J. H. Capdevila: Alterations in the regulation of androgen-sensitive Cyp 4a monooxygenases cause hypertension. In: Proceedings of the National Academy of Sciences. 98, Nr. 9, 2001, S. 5211–6. bibcode:2001PNAS...98.5211H. doi:10.1073/pnas.081627898. PMID 11320253. PMC 33189 (freier Volltext).
- R Quigley, S Chakravarty, X Zhao, J. D. Imig, J. H. Capdevila: Increased renal proximal convoluted tubule transport contributes to hypertension in Cyp4a14 knockout mice. In: Nephron Physiology. 113, Nr. 4, 2009, S. 23–8. doi:10.1159/000235774. PMID 19713718. PMC 2790762 (freier Volltext).
- P Fidelis, L Wilson, K Thomas, M Villalobos, A. O. Oyekan: Renal function and vasomotor activity in mice lacking the Cyp4a14 gene. In: Experimental Biology and Medicine. 235, Nr. 11, 2010, S. 1365–74. doi:10.1258/ebm.2010.009233. PMID 20943934.
- K Nakagawa, V. R. Holla, Y Wei, W. H. Wang, A Gatica, S Wei, S Mei, C. M. Miller, D. R. Cha, E Price Jr, R Zent, A Pozzi, M. D. Breyer, Y Guan, J. R. Falck, M. R. Waterman, J. H. Capdevila: Salt-sensitive hypertension is associated with dysfunctional Cyp4a10 gene and kidney epithelial sodium channel. In: Journal of Clinical Investigation. 116, Nr. 6, 2006, S. 1696–702. doi:10.1172/JCI27546. PMID 16691295. PMC 1459070 (freier Volltext).
- S Imaoka, H Ogawa, S Kimura, F. J. Gonzalez: Complete cDNA sequence and cDNA-directed expression of CYP4A11, a fatty acid omega-hydroxylase expressed in human kidney. In: DNA and cell biology. 12, Nr. 10, 1993, S. 893–9. doi:10.1089/dna.1993.12.893. PMID 8274222.
- J. V. Gainer, A Bellamine, E. P. Dawson, K. E. Womble, S. W. Grant, Y Wang, L. A. Cupples, C. Y. Guo, S Demissie, C. J. O'Donnell, N. J. Brown, M. R. Waterman, J. H. Capdevila: Functional variant of CYP4A11 20-hydroxyeicosatetraenoic acid synthase is associated with essential hypertension. In: Circulation. 111, Nr. 1, 2005, S. 63–9. doi:10.1161/01.CIR.0000151309.82473.59. PMID 15611369.
- J. V. Gainer, M. S. Lipkowitz, C Yu, M. R. Waterman, E. P. Dawson, J. H. Capdevila, N. J. Brown, Group Aask Study: Association of a CYP4A11 variant and blood pressure in black men. In: Journal of the American Society of Nephrology. 19, Nr. 8, 2008, S. 1606–12. doi:10.1681/ASN.2008010063. PMID 18385420. PMC 2488260 (freier Volltext).
- Z Fu, T Nakayama, N Sato, Y Izumi, Y Kasamaki, A Shindo, M Ohta, M Soma, N Aoi, M Sato, Y Ozawa, Y Ma: A haplotype of the CYP4A11 gene associated with essential hypertension in Japanese men. In: Journal of Hypertension. 26, Nr. 3, 2008, S. 453–61. doi:10.1097/HJH.0b013e3282f2f10c. PMID 18300855.
- K Sugimoto, H Akasaka, T Katsuya, K Node, T Fujisawa, I Shimaoka, O Yasuda, M Ohishi, T Ogihara, K Shimamoto, H Rakugi: A polymorphism regulates CYP4A11 transcriptional activity and is associated with hypertension in a Japanese population. In: Hypertension. 52, Nr. 6, 2008, S. 1142–8. doi:10.1161/HYPERTENSIONAHA.108.114082. PMID 18936345.
- H Ding, G Cui, L Zhang, Y Xu, X Bao, Y Tu, B Wu, Q Wang, R Hui, W Wang, R. T. Dackor, G. E. Kissling, D. C. Zeldin, D. W. Wang: Association of common variants of CYP4A11 and CYP4F2 with stroke in the Han Chinese population. In: Pharmacogenetics and Genomics. 20, Nr. 3, 2010, S. 187–94. doi:10.1097/FPC.0b013e328336eefe. PMID 20130494. PMC 3932492 (freier Volltext).
- D. E. Stec, R. J. Roman, A Flasch, M. J. Rieder: Functional polymorphism in human CYP4F2 decreases 20-HETE production. In: Physiological Genomics. 30, Nr. 1, 2007, S. 74–81. doi:10.1152/physiolgenomics.00003.2007. PMID 17341693.
- C Fava, M Ricci, O Melander, P Minuz: Hypertension, cardiovascular risk and polymorphisms in genes controlling the cytochrome P450 pathway of arachidonic acid: A sex-specific relation?. In: Prostaglandins & Other Lipid Mediators. 98, Nr. 3–4, 2012, S. 75–85. doi:10.1016/j.prostaglandins.2011.11.007. PMID 22173545.
- A Munshi, V Sharma, S Kaul, A Al-Hazzani, A. A. Alshatwi, G Shafi, R Koppula, S. B. Mallemoggala, A Jyothy: Association of 1347 G/A cytochrome P450 4F2 (CYP4F2) gene variant with hypertension and stroke. In: Molecular Biology Reports. 39, Nr. 2, 2012, S. 1677–82. doi:10.1007/s11033-011-0907-y. PMID 21625857.
- Z Fu, T Nakayama, N Sato, Y Izumi, Y Kasamaki, A Shindo, M Ohta, M Soma, N Aoi, M Sato, K Matsumoto, Y Ozawa, Y Ma: A haplotype of the CYP4F2 gene is associated with cerebral infarction in Japanese men. In: American Journal of Hypertension. 21, Nr. 11, 2008, S. 1216–23. doi:10.1038/ajh.2008.276. PMID 18787519.
- C Tesson, M Nawara, M. A. Salih, R Rossignol, M. S. Zaki, M Al Balwi, R Schule, C Mignot, E Obre, A Bouhouche, F. M. Santorelli, C. M. Durand, A. C. Oteyza, K. H. El-Hachimi, A Al Drees, N Bouslam, F Lamari, S. A. Elmalik, M. M. Kabiraj, M. Z. Seidahmed, T Esteves, M Gaussen, M. L. Monin, G Gyapay, D Lechner, M Gonzalez, C Depienne, F Mochel, J Lavie, L Schols: Alteration of fatty-acid-metabolizing enzymes affects mitochondrial form and function in hereditary spastic paraplegia. In: The American Journal of Human Genetics. 91, Nr. 6, 2012, S. 1051–64. doi:10.1016/j.ajhg.2012.11.001. PMID 23176821. PMC 3516610 (freier Volltext).
- S. B. Wortmann, M Espeel, L Almeida, A Reimer, D Bosboom, F Roels, A. P. De Brouwer, R. A. Wevers: Inborn errors of metabolism in the biosynthesis and remodelling of phospholipids. In: Journal of Inherited Metabolic Disease. 38, Nr. 1, 2015, S. 99–110. doi:10.1007/s10545-014-9759-7. PMID 25178427.
- A Citterio, A Arnoldi, E Panzeri, M. G. d'Angelo, M Filosto, R Dilena, F Arrigoni, M Castelli, C Maghini, C Germiniasi, F Menni, A Martinuzzi, N Bresolin, M. T. Bassi: Mutations in CYP2U1, DDHD2 and GBA2 genes are rare causes of complicated forms of hereditary spastic paraparesis. In: Journal of Neurology. 261, Nr. 2, 2014, S. 373–81. doi:10.1007/s00415-013-7206-6. PMID 24337409.
- W Yu, H Chai, Y Li, H Zhao, X Xie, H Zheng, C Wang, X Wang, G Yang, X Cai, J. R. Falck, J Yang: Increased expression of CYP4Z1 promotes tumor angiogenesis and growth in human breast cancer. In: Toxicology and Applied Pharmacology. 264, Nr. 1, 2012, S. 73–83. doi:10.1016/j.taap.2012.07.019. PMID 22841774. PMC 3439529 (freier Volltext).
- Y Li, H Zhao, Y Wang, H Zheng, W Yu, H Chai, J Zhang, J. R. Falck, A. M. Guo, J Yue, R Peng, J Yang: Isoliquiritigenin induces growth inhibition and apoptosis through downregulating arachidonic acid metabolic network and the deactivation of PI3K/Akt in human breast cancer. In: Toxicology and Applied Pharmacology. 272, Nr. 1, 2013, S. 37–48. doi:10.1016/j.taap.2013.05.031. PMID 23747687.
- H Zheng, Y Li, Y Wang, H Zhao, J Zhang, H Chai, T Tang, J Yue, A. M. Guo, J Yang: Downregulation of COX-2 and CYP 4A signaling by isoliquiritigenin inhibits human breast cancer metastasis through preventing anoikis resistance, migration and invasion. In: Toxicology and Applied Pharmacology. 280, Nr. 1, 2014, S. 10–20. doi:10.1016/j.taap.2014.07.018. PMID 25094029.
- T. F. Borin, D. A. Zuccari, B. V. Jardim-Perassi, L. C. Ferreira, A. S. Iskander, N. R. Varma, A Shankar, A. M. Guo, G Scicli, A. S. Arbab: HET0016, a selective inhibitor of 20-HETE synthesis, decreases pro-angiogenic factors and inhibits growth of triple negative breast cancer in mice. In: PLoS ONE. 9, Nr. 12, 2014, S. e116247. bibcode:2014PLoSO...9k6247B. doi:10.1371/journal.pone.0116247. PMID 25549350. PMC 4280215 (freier Volltext).
- L Zheng, X Li, Y Gu, X Lv, T Xi: The 3'UTR of the pseudogene CYP4Z2P promotes tumor angiogenesis in breast cancer by acting as a ceRNA for CYP4Z1. In: Breast Cancer Research and Treatment. 150, Nr. 1, 2015, S. 105–18. doi:10.1007/s10549-015-3298-2. PMID 25701119.
- M Cizkova, G Cizeron-Clairac, S Vacher, A Susini, C Andrieu, R Lidereau, I Bièche: Gene expression profiling reveals new aspects of PIK3CA mutation in ERalpha-positive breast cancer: Major implication of the Wnt signaling pathway. In: PLoS ONE. 5, Nr. 12, 2010, S. e15647. bibcode:2010PLoSO...515647C. doi:10.1371/journal.pone.0015647. PMID 21209903. PMC 3012715 (freier Volltext).
- A Alexanian, B Miller, R. J. Roman, A Sorokin: 20-HETE-producing enzymes are up-regulated in human cancers. In: Cancer genomics & proteomics. 9, Nr. 4, 2012, S. 163–9. PMID 22798501. PMC 3601443 (freier Volltext).
- W Yu, L Chen, Y. Q. Yang, J. R. Falck, A. M. Guo, Y Li, J Yang: Cytochrome P450 ω-hydroxylase promotes angiogenesis and metastasis by upregulation of VEGF and MMP-9 in non-small cell lung cancer. In: Cancer Chemotherapy and Pharmacology. 68, Nr. 3, 2011, S. 619–29. doi:10.1007/s00280-010-1521-8. PMID 21120482. PMC 3839420 (freier Volltext).
- A Alexanian, V. A. Rufanova, B Miller, A Flasch, R. J. Roman, A Sorokin: Down-regulation of 20-HETE synthesis and signaling inhibits renal adenocarcinoma cell proliferation and tumor growth. In: Anticancer Research. 29, Nr. 10, 2009, S. 3819–24. PMID 19846914. PMC 2807614 (freier Volltext).
- A Alexanian, A Sorokin: Targeting 20-HETE producing enzymes in cancer - rationale, pharmacology, and clinical potential. In: OncoTargets and Therapy. 6, 2013, S. 243–55. doi:10.2147/OTT.S31586. PMID 23569388. PMC 3615879 (freier Volltext).
- G. I. Murray, S Patimalla, K. N. Stewart, I. D. Miller, S. D. Heys: Profiling the expression of cytochrome P450 in breast cancer. In: Histopathology. 57, Nr. 2, 2010, S. 202–11. doi:10.1111/j.1365-2559.2010.03606.x. PMID 20716162.
- D Downie, M. C. McFadyen, P. H. Rooney, M. E. Cruickshank, D. E. Parkin, I. D. Miller, C Telfer, W. T. Melvin, G. I. Murray: Profiling cytochrome P450 expression in ovarian cancer: Identification of prognostic markers. In: Clinical Cancer Research. 11, Nr. 20, 2005, S. 7369–75. doi:10.1158/1078-0432.CCR-05-0466. PMID 16243809.
- M. A. Rieger, R Ebner, D. R. Bell, A Kiessling, J Rohayem, M Schmitz, A Temme, E. P. Rieber, B Weigle: Identification of a novel mammary-restricted cytochrome P450, CYP4Z1, with overexpression in breast carcinoma. In: Cancer Research. 64, Nr. 7, 2004, S. 2357–64. doi:10.1158/0008-5472.can-03-0849. PMID 15059886.
- M Guo, R. J. Roman, J. R. Falck, P. A. Edwards, A. G. Scicli: Human U251 glioma cell proliferation is suppressed by HET0016 N-hydroxy-N'-(4-butyl-2-methylphenyl)formamidine, a selective inhibitor of CYP4A. In: Journal of Pharmacology and Experimental Therapeutics. 315, Nr. 2, 2005, S. 526–33. doi:10.1124/jpet.105.088567. PMID 16081682.
- N. C. Ward, I. J. Tsai, A Barden, F. M. Van Bockxmeer, I. B. Puddey, J. M. Hodgson, K. D. Croft: A single nucleotide polymorphism in the CYP4F2 but not CYP4A11 gene is associated with increased 20-HETE excretion and blood pressure. In: Hypertension. 51, Nr. 5, 2008, S. 1393–8. doi:10.1161/HYPERTENSIONAHA.107.104463. PMID 18391101.
- I. J. Tsai, K. D. Croft, T. A. Mori, J. R. Falck, L. J. Beilin, I. B. Puddey, A. E. Barden: 20-HETE and F2-isoprostanes in the metabolic syndrome: The effect of weight reduction. In: Free Radical Biology and Medicine. 46, Nr. 2, 2009, S. 263–70. doi:10.1016/j.freeradbiomed.2008.10.028. PMID 19013235.
- H. Wen, J. Östman, K. J. Bubb, C. Panayiotou, J. V. Priestley, M. D. Baker, A. Ahluwalia: 20-Hydroxyeicosatetraenoic acid (20-HETE) is a novel activator of transient receptor potential vanilloid 1 (TRPV1) channel. In: Journal of Biological Chemistry. 287, Nr. 17, 2012, S. 13868–76. doi:10.1074/jbc.M111.334896. PMID 22389490. PMC 3340178 (freier Volltext).

