α-Ketoglutarat-Dehydrogenase E1
α-Ketoglutarat-Dehydrogenase E1 ist das Enzym in Bakterien und Eukaryoten, das als E1-Untereinheit des α-Ketoglutarat-Dehydrogenase-Komplexes die Decarboxylierung von α-Ketoglutarat katalysiert. Diese Reaktion ist Bestandteil des Citratzyklus. Außerdem kann α-Ketoadipat decarboxyliert werden, was beim Abbau der Aminosäure Lysin notwendig ist. Der Proteinkomplex ist in den Mitochondrien lokalisiert. Seltene Mutationen im OGDH-Gen können zum E1-Mangel und dieser zur seltenen Ketoglutarazidurie führen.[1][2]
| α-Ketoglutarat-Dehydrogenase E1 | ||
|---|---|---|
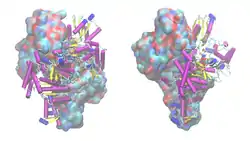 | ||
| Bänder-/Oberflächenmodell des KDH-E1-Dimers von Escherichia coli mit Thiamin-Analog als Kalotten, nach PDB 2GDJ | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 983 Aminosäuren | |
| Kofaktor | TPP | |
| Bezeichner | ||
| Gen-Name | OGDH | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.2.4.2, Oxidoreduktasen | |
| Reaktionsart | Decarboxylierung, Succinylierung | |
| Substrat | 2-Ketoglutarat + Lipoyllysin-DLST | |
| Produkte | Succinyllipoyllysin-DLST + CO2 | |
| Vorkommen | ||
| Übergeordnetes Taxon | Bakterien, Eukaryoten | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 4967 | 18293 |
| Ensembl | ENSG00000105953 | ENSMUSG00000020456 |
| UniProt | Q02218 | Q60597 |
| Refseq (mRNA) | NM_001003941 | NM_001252282 |
| Refseq (Protein) | NP_001003941 | NP_001239211 |
| Genlocus | Chr 7: 44.61 – 44.71 Mb | Chr 11: 6.29 – 6.36 Mb |
| PubMed-Suche | 4967 | 18293 |
Katalysierte Reaktion
Die Decarboxylierung von Ketoglutarat findet am Thiamin als katalytischem Zentrum statt, welches eine Atombindung mit Ketoglutarat bildet, so dass Succinyl-Thiamin-Pyrophosphat unter Abspaltung von CO2 entsteht.
![]() +
+ 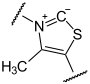
 + CO2 (R=OOC-CH2-CH2-)
+ CO2 (R=OOC-CH2-CH2-)
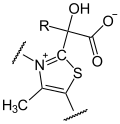
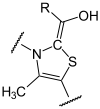
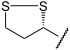
Dieser Succinylrest (syn. Bernsteinsäure) des TPP wird von der α-Liponsäure übernommen (Oxidation). Sie ist an die Lipoat-DSLT-Untereinheit kovalent gebunden. Es entsteht S-Succinyl-Hydrolip(oat/onamid).
 +
+ 
 +
+ 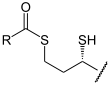 (R=OOC-CH2-CH2-)
(R=OOC-CH2-CH2-)
Damit verläuft die Reaktion äquivalent zur Decarboxylierung von Pyruvat durch die Pyruvatdehydrogenase E1.
Literatur
- Bunik V, Kaehne T, Degtyarev D, Shcherbakova T, Reiser G: Novel isoenzyme of 2-oxoglutarate dehydrogenase is identified in brain, but not in heart. In: FEBS J.. 275, Nr. 20, Oktober 2008, S. 4990–5006. doi:10.1111/j.1742-4658.2008.06632.x. PMID 18783430.
Weblinks
Einzelnachweise
- UniProt Q02218
- Orphanet: Oxoglutarazidurie