Étard-Reaktion
Die Étard-Reaktion ist eine Namensreaktion in der Organischen Chemie, die nach ihrem Entdecker Alexandre Léon Étard (1852–1910) benannt wurde.
Übersichtsreaktion
Dabei wird das Kohlenstoffatom eines alkylsubstituierten Phenylrestes (Toluol) mit Chrom(VI)-oxiddichlorid zum korrespondierenden Aldehyd oxidiert. Im folgenden Beispiel reagiert ein methylsubstituierter Phenylrest zu Benzaldehyd.
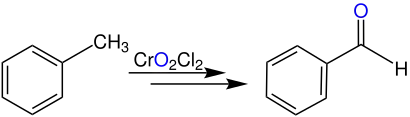
Analog kann ein Methylsubstituent an einem Cycloalkylring (z. B. in Methylcyclohexan) auch zu einer Formylgruppe oxidiert werden.[1]
Reaktionsmechanismus
Der folgende Mechanismus wird von Ji Jack Li vorgeschlagen.[2] Im ersten Schritt findet eine En-Reaktion statt, bei welcher das Toluol 1 mit Chrom(VI)-oxiddichlorid zur Reaktion gebracht wird. Dabei entsteht der rote bis braune Étard-Komplex 2.
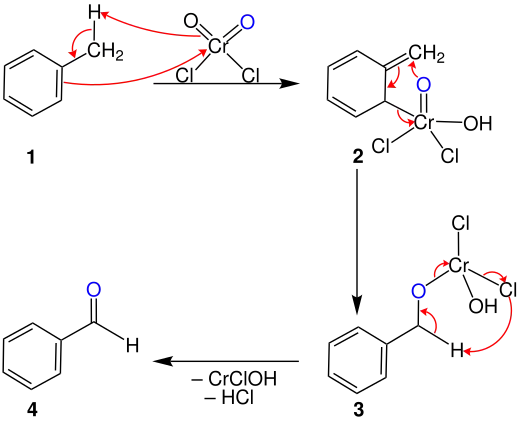
Dieser zerfällt durch eine [2+3]-sigmatrope Umlagerungsreaktion zu Verbindung 3. Dabei sind reduzierende Bedingungen erforderlich, um die Oxidation zur Carbonsäure zu verhindern. Durch eine weitere Umlagerungsreaktion entsteht der Benzaldehyd 4.[3]
Geschichtlicher Hintergrund
Der Reaktionsmechanismus der Étard-Reaktion ist bis heute nicht vollständig aufgeklärt. Der beschriebene Mechanismus von Ji Jack Li ist nur einer von vielen vorgeschlagenen. Nachdem Étard seinen Mechanismus 1881 formulierte, wurde vor allem über die Struktur des entstehenden Chelatkomplexes diskutiert. So entstand die Idee der Existenz eines Chrom(IV)-Chelatkomplexes 5.
Rhode nahm die Debatte 1901 zum Anlass, unterschiedliche Oxidationsstufen des Chroms im Rahmen der Étard-Reaktion zu untersuchen. Dabei formulierte er den Chelatkomplex 6. Im Jahre 1951 brachten Tillotson und Houston zwei Mol der Chromverbindung mit nur einem Mol der organischen Verbindungen zur Reaktion.[4] Auch wenn diese Formel aus anderen Reaktionen bereits bekannt war, fällt es schwer eine Chrom(VI)-Verbindung mit einer Koordinationszahl von fünf zu akzeptieren.[5]
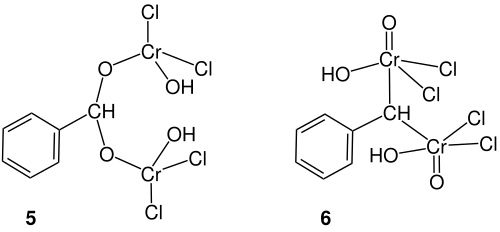
Slack und Waters brachten den Ansatz einer radikalischen Reaktion in die Diskussion ein, wobei die Additionsreaktion des ersten Chrom(VI)-oxiddichloridmoleküls den langsamen und damit geschwindigkeitsbestimmenden Schritt darstellt. Somit entstanden viele verschiedene Mechanismen, von denen manche wahrscheinlicher sind als andere. Der von Ji Jack Li vorgeschlagene ist einer der aktuellsten. Für den Zerfall des Komplexes, den Einfluss des Lösungsmittels und anderen Details wurden ähnlich viele Möglichkeiten vorgeschlagen.[6] Daraus entstanden viele Varianten der Étard-Reaktion, welche die Substratbreite deutlich erhöhten. Die Reaktion wird von Umlagerungsreaktionen gestört, sodass beispielsweise Ketone als Nebenprodukte entstehen.[7]
Praktische Bedeutung
Die osmophore Aldehydgruppe kennzeichnet sich häufig durch angenehme Gerüche. Aldehyde gelten als sehr reaktionsfreudig und werden darum häufig in Additions-, Kondensations- oder Polymerisationsreaktionen verwendet. So werden aus niederen Aldehyden häufig Kunststoffe und Kunstharze. Höhere Aldehyde werden zu Riechstoffen, wie zum Beispiel Parfüms, verarbeitet. Der Geruch des im Beispiel erhaltenen Benzaldehyd wird häufig mit dem Geruch von Marzipan oder Mandeln verglichen. Im Labor dient es häufig als Lösungsmittel und wird zur Herstellung von Zimtsäure und Pharmazeutika verwendet. Triphenylmethanfarbstoffe werden ebenfalls aus Benzaldehyd synthetisiert. Sie finden hauptsächlich in der Drucktechnik Anwendung.
Weitere Synthesen
Großtechnisches Verfahren zur Darstellung von Aldehyden
Laborverfahren zur Darstellung von Aldehyden
Literatur
- Jie Jack Li: Name reactions, a collection of detailed reaction mechanism.Vol 1.Springer 2002, S. 113. ISBN 3-540-43024-5.
- Hermann Römpp, Jürgen Falbe, Eckard Amelingmeier: Römpp-Lexikon Chemie, Vol 9. Thieme-Verlag, Stuttgart 1999. ISBN 3-13-107830-8.
- Michael B. Smith: March’s advanced organic chemistry. Reactions, mechanism, and structure, Vol 7. John Wiley & Sons, New Jersey 2013, S. 1479–1450. ISBN 978-0-470-46259-1.
Einzelnachweise
- A. Hassner, I. Namboothiri: Organic Syntheses Based on Name Reactions, 3. Auflage, Elsevier, 2012, S. 145, ISBN 978-0-08-096630-4.
- Owen H. Wheeler: Étard Reaction: I. Its Scope and Limitation with Substituted Toluenes. In: Canadian Journal of Chemistry. 36 (4), 1958, S. 667–671, doi:10.1139/v58-093.
- Ileana Necsoiu, A. T. Balaban, I. Pascaru, Elvira Sliam, M. Elian, C. D. Nenitzescu: The mechanism of the etard reaction. In: Tetrahedron. 19, Nr. 7, 1963, S. 1133–1142, doi:10.1016/S0040-4020(01)98572-2.
- C. N. Renţea, I. Necşoiu, M. Renţes, A. Ghenciulescu, C. D. Nenitzescu: Étard reaction—III: Oxidation of N-propylbenzene and methylcyclohexane with chromyl chloride. In: Tetrahedron. 22, Nr. 10, 1966, S. 3501–3513, doi:10.1016/S0040-4020(01)92538-4.
- C. N. Renţea, I. Necşoiu, A. Ghenciulescu, C. D. Nenitzescu, V. Przemetchi: Étard reaction—II: Structure of the chromyl chloride complexes of Phenylmethanes. In: Tetrahedron. 22, Nr. 9, 1966, S. 3037–3045, DOI: 10.1016/S0040-4020(01)82283-3.
- Winslow H. Hartford, Marc Darrin: The Chemistry Of Chromyl Compounds. In: Chemical Reviews, 58, 1958, S. 1–61, doi:10.1021/cr50019a001.
- Kenneth B. Wiberg, Brian Marshall, Gordon Foster: Some observations on the étard reaction. In: Tetrahedron Letters. 3, Nr. 8, 1962, S. 345–348, doi:10.1016/S0040-4039(00)70878-1.