Zinkdiphosphat
Zinkdiphosphat ist eine anorganische chemische Verbindung des Zinks aus der Gruppe der Diphosphate.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
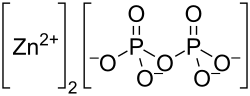 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Zinkdiphosphat | |||||||||||||||
| Andere Namen |
Zinkpyrophosphat | |||||||||||||||
| Summenformel | Zn2P2O7 | |||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 304,72 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
3,75 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,633[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Gewinnung und Darstellung
Zinkdiphosphat kann durch thermische Zersetzung von Ammoniumzinkphosphat gewonnen werden.[5]
Es kann auch durch Reaktion von Natriumcarbonat, Zinkoxid und Ammoniumdihydrogenphosphat gewonnen werden.[6]
Ebenfalls möglich ist die Darstellung durch Erhitzen einer stark essigsauren Lösung von Zinksulfat mit Natriumpyrophosphat.[7]
Eigenschaften
Zinkdiphosphat ist ein kristalliner farbloser Feststoff, der praktisch unlöslich in Wasser ist.[1] Beim Erhitzen in Wasser zersetzt er sich in Zn3(PO4)2 und ZnHPO4. Er besitzt eine monokline Kristallstruktur mit der Raumgruppe I2/c (Raumgruppen-Nr. 15, Stellung 8)[3] mit einer Thortveitit ähnlichen Struktur. Bei höheren Temperaturen (T > 408 K) geht er zuerst in eine Zwischenphase α2 mit der Raumgruppe C2/m (Raumgruppen-Nr. 12) und ab 500 K in den β-Aristotyp ebenfalls mit der Raumgruppe C2/m (Raumgruppen-Nr. 12) über.[8] Von der Verbindung sind auch Hydrate mit 2,3,4 und 5 Teilen Kristallwasser bekannt. Das Pentahydrat setzt sich ab 358 K zum Trihydrat und dieses wiederum ab 410 K zum Anhydrat um. Das Pentahydrat hat eine orthorhombische Kristallstruktur mit der Raumgruppe Pmmm (Raumgruppen-Nr. 47).[2]
Verwendung
Zinkdiphosphat wird als Pigment verwendet.[9] Es kann auch zur gravimetrischen Bestimmung von Zink verwendet werden.[10]
Einzelnachweise
- Eintrag zu Zinkpyrophosphat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- A. Durif: Crystal Chemistry of Condensed Phosphates. Springer Science & Business Media, 2013, ISBN 978-1-4757-9894-4, S. 28 (eingeschränkte Vorschau in der Google-Buchsuche).
- R. Blachnik: Taschenbuch für Chemiker und Physiker Band 3: Elemente, anorganische Verbindungen und Materialien, Minerale. Springer-Verlag, 2013, ISBN 978-3-642-58842-6 (eingeschränkte Vorschau in der Google-Buchsuche).
- M.A. Petrova, V.I. Shitova, G.A. Mikirticheva, V.F. Popova, A.E. Malshikov: New data on Zn2P2O7 phase transformations. In: Journal of Solid State Chemistry. 119, 1995, S. 219, doi:10.1016/0022-4596(95)80035-N.
- Crispin Calvo: THE CRYSTAL STRUCTURE AND PHASE TRANSITIONS OF β-Zn2P2O7. In: Canadian Journal of Chemistry. 43, 1965, S. 1147, doi:10.1139/v65-152.
- A. Jarboui, A. Ben Rhaeim, F. Hlel, K. Guidara, M. Gargouri: NMR study and electrical properties investigation of Zn2P2O7. In: Ionics. 16, 2010, S. 67, doi:10.1007/s11581-009-0333-5.
- Rudolf Ochs: Praktikum der Qualitativen Analyse Für Chemiker · Pharmazeuten und Mediziner. Springer-Verlag, 2013, ISBN 978-3-662-28315-8, S. 117 (eingeschränkte Vorschau in der Google-Buchsuche).
- Stöger B., Weil M., Dušek M.: The α ↔ β phase transitions of Zn2P2O7 revisited: existence of an additional intermediate phase with an incommensurately modulated structure. In: Acta Crystallographica Section B: Structural Science, Crystal Engineering and Materials. Band 70, Nr. 3, 1. Juni 2014, doi:10.1107/s205252061401049x.
- Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. CRC Press, 2016, ISBN 978-1-4398-1462-8, S. 469 (eingeschränkte Vorschau in der Google-Buchsuche).
- Arnold F. Holleman, Egon Wiberg: Lehrbuch der anorganischen Chemie. de Gruyter, 1995, ISBN 978-3-11-012641-9, S. 1493 (eingeschränkte Vorschau in der Google-Buchsuche).
