Wanderbaumelster
Die Wanderbaumelster (Dendrocitta vagabunda) ist eine Vogelart aus der Familie der Rabenvögel (Corvidae). Ihr Verbreitungsgebiet sind der indische Subkontinent, Hinterindien und große Teile des subtropischen Asiens. Typische Habitate dieser Baumelster sind Wälder und Parkland, gelegentlich aber auch urbane Lebensräume. Sie ist ein großer Vertreter der Baumelstern (Dendrocitta) und hat schwarz-weiß-braunes Gefieder und einem kurzen, kräftigen Schnabel.
| Wanderbaumelster | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Wanderbaumelster (Dendrocitta vagabunda) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Dendrocitta vagabunda | ||||||||||||
| (Latham, 1790)[1] |
Wanderbaumelstern ernähren sich vorwiegend von Früchten, Kleintieren und Aas. Sie bilden Familienverbände bis hin zu kleinen Schwärmen, die gemeinsam auf Nahrungssuche gehen. Je nach geographischer Breite brüten sie zwischen Februar und Juni zwei bis sechs Eier aus. Der Nachwuchs wird von beiden Eltern gefüttert. Für die Wanderbaumelster werden neun Unterarten anerkannt, die Übergänge zwischen diesen sind jedoch fließend. Der Weltbestand der Art ist nicht bekannt, mit Ausnahme von Vietnam gilt sie jedoch in ihrem gesamten Verbreitungsgebiet als häufiger Vogel. Von BirdLife International wird sie als nicht gefährdet (least concern) eingestuft.
Merkmale
Körperbau und Gefieder
Die Wanderbaumelster ist ein relativ großer und kräftiger Singvogel mit gedrungenem Körperbau, relativ kurzen Beinen und Flügeln, einem robusten, gekrümmten Schnabel und langem Schwanz. Die Körperlänge liegt zwischen 46 und 50 cm. Beide Geschlechter erreichen ungefähr die gleiche Körpergröße, das Männchen hat aber meist einen längeren Schwanz. Vögel nördlicher Populationen werden größer als solche aus dem Süden des Verbreitungsgebiets. [2]

Wanderbaumelstern wiegen 90–130 g. Die Flügellänge beträgt 144–173 mm, der Laufknochen hat eine Länge von 32–37 mm. Der kurze, gekrümmte und kräftige Schnabel misst vom Ansatz bis zur Spitze 30–37 mm. Der Schwanz wird zwischen 189 und 363 mm lang. Dabei unterscheiden sich die Unterarten teilweise sehr stark: Während die Schwanzfedern bei der südwestindischen Unterart D. vagabunda parvula 189–239 mm lang werden, beträgt ihre Länge bei der pakistanischen Form D. vagabunda bristoli 265–363 mm. [2]

Auch die Färbung ist im Verbreitungsgebiet variabel, folgt aber stets dem gleichen Grundmuster. Die kurzen, steifen Nasalfedern und das Kopfgefieder bis hinunter zur Brust und zum Nacken sind schwarz bis grau gefärbt. Rücken und Schulterfedern zeigen ein rötliches Sandbraun, das zum Schwanz hin heller wird. Die Flügeldecken und die Schirmfedern sind hell grau bis weiß gefärbt, ebenso wie die Außenfahnen der inneren drei und in geringerem Maß die der nächsten drei Armschwingen. Der Rest des Flügels ist einheitlich schwarz, das Remicle ist gut entwickelt. Das Bauchgefieder ist heller sandbraun als die Körperoberseite und wird zu den Unterschwanzdecken hin heller. Bei einigen Unterarten kann die Körperunterseite auch ins Cremefarbene tendieren. Die Steuerfedern sind stark gestuft und an der Basis schmutzig grau. Sie werden von einer hellgrauen Subterminalbinde und einer schwarzen Endbinde geziert, wobei die Schwarzfärbung von innen nach außen einen immer größeren Anteil der Federn einnimmt. Das mittlere Federpaar, das weit über den Rest der Schwanzfedern hinausragt, hat lediglich schwarze Spitzen, während das äußerste Paar zu mehr als der Hälfte schwarz gefärbt ist. Jungvögel haben schmalere mittlere Steuerfedern und sind insgesamt heller und verwaschener gefärbt, sodass die schwarzen Gefiederanteile eher dunkelbraun und die Bauchfedern intensiver gelb erscheinen. Zudem besitzen die Schwanzfedern – mit Ausnahme des Mittelpaares – sandfarbene Spitzen, an denen die Vögel während des ersten Lebensjahres deutlich zu erkennen sind.[3] [4]
Schnabel und Wachshaut der Wanderbaumelster sind schiefergrau gefärbt, wobei die Schnabelbasis meist heller als die Spitze ist. Das Schnabelinnere und der Schnabelwinkel sind bei Jungvögeln rosa. Die Iris ist unabhängig vom Alter dunkel rotbraun, die Beine sind dunkel hornfarben bis schiefergrau. [4]
Flugbild und Fortbewegung
Die Wanderbaumelster fliegt in der Regel in niedriger Höhe und selten über den Baumkronen. Ihr Flug ist wellenförmig, die Flügelschläge sind kräftig. Der normale Flug wird bisweilen von schnellen, flatternden Flügelschlägen oder einem länger anhaltenden Gleitflug unterbrochen. Charakteristisch sind vor allem die runden, breiten Flügel und der deutlich gestufte Schwanz, dessen mittleres Federpaar weit über die anderen Steuerfedern hinausragt. Wanderbaumelstern bewegen sich meist im Geäst, wo sie sehr agil von Zweig zu Zweig springen, klettern oder auch im Kronenbereich fliegen. Auf dem Erdboden bewegen sie sich, verglichen etwa mit Raben und Krähen (Corvus spp.), eher unbeholfen, weil ihr langer Schwanz und die kurzen Beine beim Laufen hinderlich sind. Entsprechend selten sind Wanderbaumelstern auf dem Boden zu sehen, wo sie meist hüpfen und dabei den Schwanz hochstellen.[5] [6]
Lautäußerungen
.jpg.webp)
Die Rufe der Wanderbaumelster gehören zur typischen Klangkulisse indischer Wald- und Parklandschaften. Sie verfügt über ein breites Repertoire von sowohl lauten und krächzenden als auch weichen und melodiösen Rufen. Charakteristisch ist vor allem das melodiöse, dreisilbige ki-ko-kik oder bob-o-link, das die Vögel mit gekrümmtem Rücken und senkrecht gewinkeltem Schwanz von einer Sitzwarte aus von sich geben. Auch ein ratterndes Geschacker, ähnlich dem der Echten Elstern (Pica), ist ein häufig zu vernehmender Ruf und dient wahrscheinlich als Warnsignal. Als eine charakteristische Lautäußerung gilt auch ein metallisches ta-tschack tschak tschak. In der Brutsaison lässt die Wanderbaumelster ein langgezogenes mii-aao vernehmen; balzende Paare kommunizieren mit einer Vielzahl musikalischer Kehl- und Krächzlaute. [7]
Verbreitung und Wanderungen
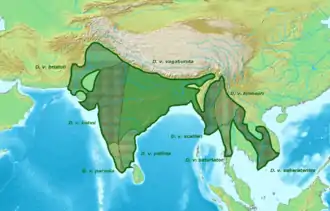
Die Wanderbaumelster kommt fast im gesamten Kontinentalasien südlich des Himalayas vor. Ihr Artareal wird weitgehend von den Gebirgszügen des südlichen Asiens und den Vegetationsräumen bestimmt. Die westliche Grenze des Verbreitungsgebiets verläuft in Südwest-Richtung entlang der pakistanischen Hindukusch-Ausläufer.
Im Westen des Indus existiert mit dem Rann von Kachchh und der Thar eine Verbreitungslücke. Davon abgesehen ist aber fast ganz Indien und Bangladesch von der Wanderbaumelster besiedelt, lediglich der Himalaya und seine Ausläufer bilden eine Verbreitungsgrenze. In Südostasien reicht das Verbreitungsgebiet bis auf die nördliche Malaiische Halbinsel und die Indochinesische Halbinsel, spart aber den Osten Thailands und die Westküste Vietnams aus. Auf Sri Lanka fehlt die Wanderbaumelster trotz geeigneter Habitate, dort existiert auch keine andere Art der Gattung. Im Nordosten schließt entlang des Himalayas und in China das Verbreitungsgebiet der Graubrustbaumelster (Dendrocitta formosae) an; im Goldenen Dreieck und in Orissa überschneiden sich die beiden Artareale. In Singapur wurde die Wanderbaumelster eingeführt.[8] [9]
Die Wanderbaumelster ist, anders als ihr Name nahelegt, kein Zugvogel. Einige Populationen unternehmen aber saisonale Höhenwanderungen. So wandern Brutpaare vom Tiefland oft ins Hügelland und verlassen im Winter die höheren Lagen. Das gilt insbesondere für die Populationen am Südrand des Himalayas. [6]
Lebensraum

Ausreichender Baumbestand ist wesentlich für die Habitatwahl der Wanderbaumelster. Zwar werden von lichten Wäldern bis hin zu landwirtschaftlichen Flächen sehr verschiedene Lebensräume von ihr besiedelt, ausschlaggebend sind jedoch die Brut- und Schlafmöglichkeiten. [6] Dabei nutzt die Wanderbaumelster vorwiegend Laubbäume und Lebensräume im Tief- und Hügelland. Sie ist dort sowohl in trockenen wie auch in feuchten, offenen und halboffenen Wäldern anzutreffen, aber auch auf Feldern mit Baumbestand, in Buschsteppen und Plantagen. Dichte Wälder werden gemieden. Als einzige Art der Baumelstern[10] dringt die Wanderbaumelster auch in urbane Habitate vor. In den Städten und Dörfern des südlichen Asiens ist sie ein häufiger Vogel, der Gärten, Parks und ähnliche anthropogene Lebensräume bewohnt. [11]
Die vertikale Verbreitung der Wanderbaumelster reicht vom Tief- bis ins Hügelland. In der Regel werden Lagen bis zu einer Höhe von 1000 m besiedelt.[12] Örtlich, etwa am Südrand des Himalayas, ist die Art auch bis auf 2100 m anzutreffen. Voraussetzung dabei ist das zumindest vereinzelte Vorhandensein von Bäumen oder Gehölzpflanzen entlang der Hänge oder in den Tälern. In Regionen, in denen sich das Verbreitungsgebiet mit dem der Graubrustbaumelster (D. formosae) überschneidet, weicht die Wanderbaumelster in tiefere Lagen oder in anthropogene Habitate aus.[13] [6]
Lebensweise
Ernährung

Wanderbaumelstern nutzen ein breites Spektrum an Nahrungsquellen. Sie fressen vor allem Früchte, Beeren, Samen und Wirbellose. Aufgrund ihrer Vorliebe für fleischige Früchte wird die Art mancherorts als Schädling verfolgt, teilweise aber auch als Fressfeind des Sagowurms geschätzt. Sie frisst Früchte aller Größen, von den Beeren des Zedrachbaumes (Melia azedarach) bis hin zu Papayas und den Kürbisfrüchten von Trichosanthes tricuspidata. Am häufigsten werden allerdings die Früchte verschiedener Feigenarten (Ficus spp.) gefressen. Daneben finden sich auch kleine Wirbeltiere (Eidechsen, Vögel und Nagetiere), Aas und menschliche Abfälle in ihrer Nahrung. Eier werden wahrscheinlich weniger häufig gefressen als landläufig angenommen.[11] [5]

Die Bindung der Wanderbaumelster an Bäume gilt auch für die Ernährung. Der Großteil der Nahrung wird im Geäst oder im Gebüsch erbeutet, gesammelt und gefressen. Wanderbaumelstern kommen eher selten auf den Boden, etwa wenn sie von ergiebigen Futterquellen angelockt werden oder trinken und baden möchten. Bei der Nahrungssuche agieren sie – je nach Situation – sehr scheu oder überaus neugierig und ohne Anzeichen von Furcht. Häufig schließen sie sich anderen Vogelarten an und streifen zusammen mit Koels, Flaggendrongos[11] und Grüntauben durch das Geäst und fangen von ihnen aufgescheuchte Insekten. [6] Zusammen mit Kuhreihern picken sie Parasiten aus dem Fell von Sambars (Rusa unicolor), die den Vögeln befallene Körperstellen bereitwillig anbieten.[14] Wie auch andere Rabenvögel versteckt die Wanderbaumelster wahrscheinlich überschüssige Nahrung. Es ist allerdings unbekannt, auf welche Weise und an welchen Orten sie dies tut. Gefressenes Aas stammt meist von Kadavern größerer Säugetiere. Dort drängeln sich Wanderbaumelstern in der Rangordnung vor, was sie aufgrund ihrer Wendigkeit auch meist unbeschadet überstehen. Auch abseits von Kadavern können Wanderbaumelstern sehr forsch auftreten: In Tourismusgebieten fressen wilde Vögel Besuchern aus der Hand; in Städten und Dörfern dringen sie teils auch in Häuser ein, um dort Insekten, Fledermäuse und Geckos zu fangen. [11]
Sozial- und Territorialverhalten

Verglichen mit anderen Rabenvögeln sind Wanderbaumelstern moderat sozial. Sie bilden Paare oder lockere, vier- bis fünfköpfige Familienverbände, die gemeinsam auf Nahrungssuche gehen oder durchs Geäst wandern. Bei gutem Nahrungsaufkommen können sich zeitweilig aber auch bis zu 20 Tiere zusammenschließen. Diese Gruppen schließen sich wiederum auch zu gemischten Schwärmen mit anderen Vogelarten zusammen. [5]
Fortpflanzung und Brut
Wie viele andere Rabenvögel bilden Wanderbaumelstern häufig lebenslange Brutpaare. Während der Balz sitzen beide Partner ein paar Zentimeter voneinander entfernt auf einer Sitzwarte, bewegen den Kopf ruckartig in Richtung des anderen, strecken den Hals, bis sich ihre Schnäbel fast berühren und geben glucksende und krähende Laute von sich. Beide Geschlechter beteiligen sich am Bau des Nests, der Bebrütung der Eier und der Fütterung der Jungen. [7]
Wanderbaumelstern brüten zwischen Februar und Juli. Die Hauptbrutzeit liegt bei den südlichsten Unterarten zwischen März und April und verschiebt sich mit zunehmender geographischer Breite immer weiter nach hinten. Das Nest entspricht der für die Familie Corvidae typischen Form: Eine unordentliche, lockere Konstruktion in Form einer tiefen Schüssel, die auf einer Plattform aus dickeren Zweigen liegt[11]. Oft verwebt die Wanderbaumelster für das Nest Dornzweige mit feineren, unbedornten Zweigen und feinen Wurzeln. Für die Größe der Art ist es vergleichsmäßig klein und unauffällig. Die Vögel platzieren es in 6–8 m Höhe in großen, tendenziell freistehenden und entlaubten Bäumen, beispielsweise Sheesham (Dalbergia sissoo), Indischem Weihrauch (Boswellia serrata) oder der Akazie Acacia concinna. Das Gelege besteht aus 2–6 Eiern, im Durchschnitt sind es zwischen 4 und 5.[6] Nördliche Populationen legen größere Gelege als südliche.[11] Die Eier sind durchschnittlich 29,0 × 21,5 mm groß und sehr variabel geformt und gefärbt. Meist haben sie eine rosig-weiße Grundfarbe und sind mit rotbraunen und grauen Tüpfeln überzogen, vor allem am stumpfen Ende. Brut- und Nestlingsdauer sind unbekannt, die Jungen verbleiben mehrere Monate oder Jahre bei den Elternvögeln.[6] [15]
Krankheiten und Mortalitätsursachen
Endoparasiten der Wanderbaumelster sind unter anderem das Trypanosom Trypanosoma corvi[16] und der Saugwurm Haplorchis vagabundi.[17] Wie auch bei vielen anderen Corviden sind die Nestlinge anfällig für eine durch Babesia frugilegica ausgelöste Babesiose.[18] Im Gefieder der Art gefundene Ektoparasiten umfassen die Kieferläuse Bruelia meinertzhageni und Philopterus vagabunda, deren Typwirt die Wanderbaumelster ist,[19] sowie die Lausfliege Ornithophila metallica.[20]
Systematik und Taxonomie
Die Wanderbaumelster wurde 1790 von John Latham in seinem Verzeichnis Index ornithologicus sive Systema ornithologiæ anhand eines Museumsbalges beschrieben. Er ordnete sie damals noch den Racken (Coraciidae) als Coracias vagabunda zu.[1] In die Gattung Dendrocitta stellte sie erst John Gould 1833. Gould reichte auch eine Erklärung für das von Latham gewählte Artepitheton nach: Anders als die europäische Elster (Pica pica) verharre die Wanderbaumelster nicht ruhig auf einer Sitzwarte, sondern bewege sich unablässig von Baum zu Baum durch das Geäst. [21] Der Name „Lanius rufus“ (beziehungsweise „Dendrocitta rufa“) von Giovanni Antonio Scopoli aus dem Jahr 1786 hat keine Gültigkeit, da der gleiche Name bereits 1766 von Carl von Linné für eine andere Vogelart verwendet worden war.[22]
Die innere Systematik der Baumelstern wurde bisher nicht näher untersucht. Derek Goodwin ordnete die Wanderbaumelster aufgrund äußerer Merkmale als ursprünglichen Vertreter ihrer Gattung ein und stellte sie in die Nähe der Maskenbaumelster (D. frontalis).[23] Für die Wanderbaumelster werden neun Unterarten anerkannt. Die Variation verläuft allerdings weitgehend klinal, das heißt die Übergänge zwischen den einzelnen Unterarten sind fließend. Vögel aus dem Nordwesten des Verbreitungsgebiets sind tendenziell am größten und hellsten, südlichere Formen kleiner, östliche Formen dunkler.[24] [6]
Für taxonomische Verwirrung sorgte lange Zeit die 1846 von Edward Blyth aufgestellte Unterart D. vagabunda pallida. Blyth hatte das Typusexemplar der Unterart von Wilhelm Behn zur Verfügung gestellt bekommen. Dieser hatte den Balg auf einem Markt in Kalkutta gekauft. Blyth war der Ansicht, der Vogel stamme aus dem westlichen Himalaya. Spätere Autoren übernahmen diese Typlokalität in der Regel unkritisch, Claud Buchanan Ticehurst präzisierte sie 1922 auf Shimla. Obwohl Blyths Maßangaben nicht mit denen nordwestlicher Populationen übereinstimmten, wurden höchstens die Maße des Holotyps, nicht die Typlokalität in Zweifel gezogen. Lediglich Raymond Andrew Paynter, Jr. stellte 1961 Blyths Ortsangabe in Frage und forderte, Galkund in den Dangs als neuen Typort festzulegen, um Blyths Typexemplar in die klinale Variation einzuordnen.[25] Erst Frank Steinheimer konnte in einer Revision des Holotyps nachweisen, dass dieser aus dem südwestlichen Indien stammte. Da die ursprüngliche Typlokalität nicht mehr zu ermitteln war, legte Steinheimer Chennai als neuen Typort fest. Das hatte zur Folge, dass D. vagabunda pallida den Namen D. vagabunda vernayi für die südöstliche Unterart der Wanderbaumelster ersetzte. Als neuen Namen für die nordwestliche Unterart legte Steinheimer D. vagabunda behni zu Ehren von Wilhelm Behn fest. [26]
| Unterart | Autor | Maße a | Gefieder | Verbreitung | Anmerkung |
|---|---|---|---|---|---|
| D. v. behni | Steinheimer, 2009[27] | Flügel: ♀ 137–165 mm, ♂ 149–173 mm; Schwanz: ♀ 219–279 mm, ♂ 218–297 mm; Schnabel: ♀ 29–34 mm, ♂ 31–34 mm; Tarsus: ♀ 31 mm, ♂ 33–35 mm; Gewicht: ♀♂ 90–130 g |
Sehr helles Gefieder, Bauch fast cremefarben | Westhälfte Indiens | Bis 2009 als D. v. pallida geführt; benannt nach Wilhelm Behn, von dem das Typexemplar stammte[28] |
| D. v. bristoli | Paynter, 1961[29] | Flügel: ♀ 158–174 mm, ♂ 157–179 mm; Schwanz: ♀ 269–349 mm, ♂ 265–263 mm; Schnabel: ♀ 30–35 mm, ♂ 32–37 mm; Tarsus: ♀ 31–34 mm; ♂ 31–37 mm; Gewicht: ♀ 120–143 g, ♂ 141–146 g |
Lebhaft gefärbte Form | Pakistan und Nordwestindien | Benannt nach Melvin Lee Bristol, Botaniker und Organisator der Harvard-Yale-Expedition, auf der das Typexemplar geschossen wurde |
| D. v. kinneari | Baker, ECS, 1922[30] | Flügel: ♀♂ 137–151 mm; Schwanz: ♀♂ 195–241 mm; Schnabel: ♀♂ 31,0 Tarsus: ♀♂ 32,0[30] |
Sehr dunkle Form | Thailand und Ostmyanmar | Artepitheton ehrt Norman Boyd Kinnear |
| D. v. pallida | (Blyth, 1846)[31] | Flügel: ♀ 137–152 mm, ♂ 145–158 mm; Schwanz: ♀ 188–225 mm, ♂ 197–236 mm; Schnabel: ♀ 29–33 mm, ♂ 29–35 mm; Tarsus: ♀ 31–33 mm, ♂ 31–34 mm; Gewicht: ♀♂ 90–95 g |
Eher helle Form mit sandfarbenem Bauch und trübem Mantel | Südostindien südlich der Ostghats | Von Blyth ursprünglich als eigene Art Crypsirina pallida beschrieben. Bis 2009 als D. v. vernayi geführt; pallida lateinisch für fahl, blass[28] |
| D. v. parvula | Whistler & Kinnear, 1932 | Flügel: ♀ 131–144 mm, ♂ 133–152 mm; Schwanz: ♀ 196–204 mm, ♂ 189–239 mm; Schnabel: ♀ 29–32 mm, ♂ 31–35 mm; Tarsus: ♂ 30 mm |
Unterart mit den kräftigsten Farben und dunkel rotbraunem Rücken | Südwestliches Indien | Artepitheton parvula lateinisch für klein, gering |
| D. v. sakeratensis | Gyldenstolpe, 1920[32] | Flügel: ♀ 146 mm, ♂ 152–153 mm; Schwanz: ♀ 222 mm, ♂ 236–241 mm; Schnabel: ♀ 28 mm, ♂ 27–31 mm; Tarsus: ♀ 31 mm, ♂ 31–33 mm[32][33] |
Sehr dunkler und scharf abgegrenzter Nacken, Rücken rötlich-ocker, Körperunterseite hell ockerfarben | Ostthailand bis Vietnam | Artepitheton bezieht sich auf die Typlokalität Sakerat in Laos |
| D. v. saturatior | Ticehurst, 1922[34] | Flügel: ♀ 147 mm; Schwanz: ♀ 236 mm; Schnabel: ♀ 32 mm; Tarsus: ♀ 37 mm |
Dunkelste Unterart | Tenasserim und Südwestthailand | Artepitheton (lateinisch saturare für sättigen) bezieht sich auf die dunkle Tönung des Gefieders |
| D. v. sclateri | Baker, ECS, 1922[30] | Flügel: ♀♂ 142–164 mm; Schwanz: ♀♂ 242–282 mm; Schnabel: ♂ 33–34 mm; Tarsus: ♂ 33–35 mm |
Dunkle Form, Nacken- und Rückenfarbe gehen fließend ineinander über | Westliches Myanmar | Artepitheton ehrt William Lutley Sclater |
| D. v. vagabunda | (Latham, 1790) | Flügel: ♀ 136–161 mm, ♂ 146–168 mm; Schwanz: ♀ 198–240 mm, ♂ 204–263 mm; Schnabel: ♀ 30–34 mm, ♂ 30–35 mm; Tarsus: ♀ 31–34 mm, ♂ 31–35 mm; Gewicht: ♀ 98–118 g, ♂ 112–128 g |
Lebhaft gefärbt, Rücken und Schultern tief rotbraun, Körperunterseite rötlich-sandfarben | Osthälfte Indiens | Nominatform |
Bestand und Siedlungsdichte
Für den Weltbestand der Wanderbaumelster liegen keine Schätzungen vor. Die Art gilt aber in ihrem Verbreitungsgebiet fast durchweg als häufig bis sehr häufig. Lediglich in Vietnam wird sie als selten angesehen. BirdLife International stuft die Wanderbaumelster daher als ungefährdet (least concern) ein. [8]
Kulturgeschichte

Aelianus Tacticus berichtet über einen Vogel namens Kerkorōnos (κερκορώνος), den die Inder ihrem König verehrten. Ein griechisch-armenisches Wörterbuch aus dem Mittelalter ordnet die Dohle (Corvus monedula) diesem Wort zu. William Arnott sieht in Kerkorōnos aber vielmehr die Wanderbaumelster: Die Dohle kommt zwar häufig in Armenien, aber nur sehr lokal in Indien vor. Zudem impliziert der Wortbestandteil Kerkos (κερκος, griechisch für Schwanz), dass es sich bei dem Vogel um eine Art mit langen Steuerfedern handelte, die Dohle besitzt jedoch nur einen sehr kurzen Schwanz und ist für ein königliches Geschenk eher unauffällig gefärbt. Ein viel wahrscheinlicherer Kandidat sei die Wanderbaumelster, die durch ihren langen Schwanz und ihr kontrastreiches Gefieder auffalle. [35] Alfred Brehm erwähnt in seinem Tierleben, dass die Wanderbaumelster auf dem indischen Subkontinent traditionell ein beliebter Käfigvogel und leicht zu zähmen sei.[36]
Quellen
Literatur
- Salím Ali, S. Dillon Ripley: Handbook of the Birds of India and Pakistan. Volume 5: Larks to the Grey Hypocolius. Oxford University Press, London 1972.
- Muhammad Atiqur Rahman Ansari: Some New Ischnoceran Mallophaga in the Zoological Survey Department, Karachi. In: Pakistan Journal of Scientific Research 8 (1), 1956. S. 10–22.
- William Geoffrey Arnott: Birds in the Ancient World from A to Z. Routledge, 2007. ISBN 0-415-23851-X.
- Edward Charles Stuart Baker: The Fauna of British India, Including Ceylon and Burma. Birds – Vol. I. (Second Edition). Taylor and Francis, London 1922. (Online)
- S. C. Baugh: Contributions to our Knowledge of Digenetic Trematodes IV. In: Zeitschrift für Parasitenkunde 22 (4), 1963. doi:10.1007/BF00260191, S. 303–315.
- Edward Blyth: Notices and Descriptions of various New or Little Known Species of Birds. In: The Journal of the Asiatic Society of Bengal 15, 1846. S. 1–280. (Online)
- Alfred Brehm: Brehms Thierleben. Allgemeine Kunde des Thierreichs, Fünfter Band, Zweite Abtheilung: Vögel, Zweiter Band: Raubvögel, Sperlingsvögel und Girrvögel. Verlag des Bibliographischen Instituts, Leipzig 1882.
- E. C. Dickinson, R. W. R. J. Dekker, S. Eck, S. Somadikarta: Systematic notes on Asian birds. 45. Types of the Corvidae. In: Zoologische Verhandelingen 350. S. 111–148. (Online)
- Derek Goodwin: Crows of the World. 2. Auflage. The British Museum (Natural History), London 1986, ISBN 0-565-00979-6.
- John Gould: On a new Genus in the Family of Corvidæ. In: The Transactions of the Zoological Society 1 (1), 1833. S. 87–90. (Online)
- Nils Gyldenstolpe: Dendrocitta vagabunda sakeratensis. In: Bulletin of the British Ornithologist’s Club. 41, 1920. S. 32. (Online)
- Joseph del Hoyo, Andrew Elliot, David Christie (Hrsg.): Handbook of the Birds of the World. Volume 14: Bush-shrikes To Old World Sparrows. Lynx Edicions, Barcelona 2009. ISBN 978-84-96553-50-7.
- John Latham: Index ornithologicus sive Systema ornithologiæ. London 1790. (Online)
- David M. Leslie jr.: Rusa unicolor (Artiodactyla: Cervidae). In: Mammalian Species 43 (871), 2011. doi:10.1644/871.1, S. 1–30.
- Steve Madge, Hilary Burn: Crows & Jays. Princeton University Press, Princeton 1994, ISBN 0-691-08883-7.
- Richard M. Mitchell, James A. Dick: Ectoparasites from Nepal Birds. In: Journal of the Bobay Natural History Society 74, 1975. S. 264–274.
- Pamela C. Rasmussen, John C. Anderton: Birds of South Asia: The Ripley Guide. Volume 1: Field Guide. Lynx Edicions, Barcelona 2005. ISBN 84-87334-65-2.
- Raymond Andrew Paynter: Notes on some Corvidae from Nepal, Pakistan and India. In: Journal of the Bombay Natural History Society 58 (2), 1961. S. 379–386.
- M. A. Peirce: A Taxonomic Review of Avian Piroplasms of the Genus Babesia. In: Journal of Natural History 34 (3), 2000. doi:10.1080/002229300299507, S. 317–332. Starcovici, 1893 (Apicomplexa: Piroplasmorida: Babesiidae)
- Pamela C. Rasmussen, John C. Anderton: Birds Of South Asia The Ripley Guide Volume 2: Attributes and Status. Lynx Edicions, Barcelona 2005. ISBN 84-87334-66-0.
- Craig Robson: A Guide to the Birds of Southeast Asia. Princeton University Press, Princeton 2000. ISBN 0-691-05012-0.
- Frank D. Steinheimer: The type specimens of Corvidae (Aves) in the Museum für Naturkunde at the Humboldt-University of Berlin, with the description of a new subspecies of Dendrocitta vagabunda. In: Zootaxa 2149, 2009. S. 1–49.
- Claud Buchanan Ticehurst: Dendrocitta vagabunda saturiator. In: Bulletin of the British Ornithologist’s Club. 42, 1922. S. 56. (Online)
- Jan Votýpka, Julius Lukeš, Miroslav Oborník: '[16]Phylogenetic Relationship of Trypanosoma corvi with Other Avian Trypanosomes. In: Acta Protozoologica 43, 2004. S. 225–231.
Weblinks
- BirdLife International: Species Factsheet – Rufous Treepie (Dendrocitta vagabunda). Abgerufen am 22. Februar 2022.
- Dendrocitta vagabunda in der Roten Liste gefährdeter Arten der IUCN 2011.1. Eingestellt von: BirdLife International, 2009. Abgerufen am 2. September 2011.
Einzelnachweise
- Latham 1790, S. 171–172.
- Madge & Burn 1994, S. 112–113.
- Goodwin 1986, S. 182.
- Madge & Burn 1994, S. 112.
- Ali & Ripley 1972, S. 219.
- Madge & Burn 1994, S. 113.
- Ali & Ripley 1972, S. 219–220.
- Butchart & Ekstrom 2011. Abgerufen am 22. November 2011.
- Madge & Burn 1994, S. 36.
- del Hoyo 2009, S. 517.
- Goodwin 1986, S. 183.
- Robson 2000, S. 371.
- del Hoyo 2009, S. 501.
- Leslie 2011, S. 17.
- Ali & Ripley 1972, S. 216–221.
- Votýpka et al. 2004, 226.
- Baugh 1963, S. 303.
- Peirce 2000, S. 321.
- Ansari 1956, S. 18.
- Mitchell & Dick 1975, S. 271.
- Gould 1833, S. 87–88.
- Dickinson et al. 2004, S. 118.
- Goodwin 1986, S. 180–181.
- Rasmussen & Anderton 2005b, S. 595.
- Paynter 1961, S. 380.
- Steinheimer 2009, S. 16–17.
- Steinheimer 2009, S. 21–22.
- Steinheimer 2009, S. 21.
- Paynter 1961, S. 381.
- Baker 1922, S. 51.
- Blyth 1846, S. 30.
- Gyldenstolpe 1920, S. 32.
- Steinheimer 2009, S. 20.
- Ticehurst 1922, S. 56.
- Arnott 2007, S. 138.
- Brehm 1882, S. 70.
Eine Fußnote direkt hinter einer Aussage belegt nur diese Aussage, eine Fußnote direkt am Anschluss an ein Satzzeichen den gesamten vorausgehenden Satz. Eine Fußnote hinter einem Leerzeichen bezieht sich auf den gesamten vorangehenden Absatz.