Vigabatrin
Vigabatrin (Handelsname: Sabril; Hersteller: Sanofi) ist ein krampfunterdrückender Arzneistoff, der in der Behandlung von Epilepsien eingesetzt wird. Chemisch ist es strukturell ganz ähnlich aufgebaut wie die Überträgersubstanz Gamma-Aminobuttersäure (GABA). Aufgrund des Nebenwirkungsprofils ist seine Anwendung aber auf einzelne spezielle Formen der Epilepsie beziehungsweise sonst therapieresistente Fälle eingeschränkt.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
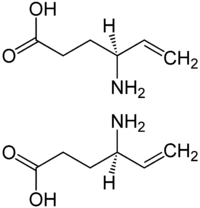 | ||||||||||||||||||||||
| (S)-Vigabatrin (oben) und (R)-Vigabatrin (unten) | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Vigabatrin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C6H11NO2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
N03AG04 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 129,16 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt |
209 °C[1] | |||||||||||||||||||||
| Löslichkeit |
gut löslich in Wasser[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Wirkmechanismus
Vigabatrin ist ein enzymaktivierter, irreversibler Hemmer des GABA-abbauenden Enzyms GABA-Aminotransferase.[3] Wegen seiner engen strukturellen Verwandtschaft zum natürlichen Substrat, wird es auch als suicide-Substrat bezeichnet. Die Enzymhemmung erhöht die Konzentration des inhibitorischen Neurotransmitters GABA. Da die Enzymhemmung irreversibel ist, hält der neuronale Effekt auch nach Absetzen des Medikaments an, bis neue GABA-Aminotransferase von den Nervenzellen bereitgestellt wird.
Anwendungsgebiete
Wegen der ungünstigen Nebenwirkungen wird Vigabatrin als Mittel der ersten Wahl nur noch beim West-Syndrom bei solchen Kindern eingesetzt, bei denen dieses als symptomatische Epilepsie im Rahmen einer tuberösen Sklerose auftritt, weil es sich hier als besonders wirksam erwiesen hat. Ansonsten kann es bei herdförmigen Epilepsien – auch solchen mit sekundärer Generalisierung – angewendet werden, wenn die Mittel der ersten Wahl nicht zu einer Anfallsfreiheit geführt haben.
Das Medikament wird oral eingenommen und hat eine Halbwertszeit von 5 bis 8 Stunden bei Jugendlichen bzw. 12 bis 13 Stunden bei Erwachsenen.
Das französische Unternehmen Orphelia Pharma erhielt im Juli 2018 seitens des CHMP eine Zulassungsempfehlung für eine neue Darreichungsform, als lösliche Tabletten speziell für Kinder. Die Dosierung kann damit in 50-mg-Schritten erhöht werden. Bis dahin war Vigabatrin in Form eines Granulats sowie überzogener Tabletten erhältlich, die geteilt bzw. verdünnt werden mussten, um die Dosis für Kinder anzupassen. Dieses Medikament ist seit dem 12. Oktober 2018 in der EU unter dem Handelsnamen Kigabeq zugelassen.[4][5][6]
Nebenwirkungen
Dosisabhängig treten Müdigkeit bis hin zur Schläfrigkeit, Kopfschmerzen, Schwindel, Konzentrations- und Gedächtnisstörungen, Verschwommensehen, Nystagmus und Gleichgewichtsstörungen auf. Dosisunabhängig allergisch kann es bei Kindern zu Erregungszuständen, bei Erwachsenen zu Depression oder Psychosen kommen. Diese Veränderungen treten meist in den ersten Monaten der Therapie auf und sind umkehrbar. Bei chronischer Einnahme kann es zu Gewichtszunahme und zur Verschlimmerung von generalisierten Epilepsien wie Absencen und myoklonischen Anfällen kommen. In bis zu 40 % der behandelten Erwachsenen wurden beidseitige Gesichtsfeldausfälle beobachtet, die zwar nur in etwa 5 % symptomatisch waren, aber wahrscheinlich nicht rückgängig zu machen sind. Sie treten unabhängig von der Dosis, der Dauer der Therapie, dem Lebensalter, der Dauer der Epilepsie und der antiepileptischen Begleitmedikation auf. Zwar kommt es nur selten zu einem wirklich beeinträchtigenden „Tunnelsehen“, dennoch hat diese Nebenwirkung dazu geführt, Vigabatrin nach anfänglich breiterer Anwendung nur noch in ausgesuchten, wohlabgewogenen Fällen einzusetzen.
Stereoisomerie
Vigabatrin ist chiral, enthält also ein Stereozentrum. Es gibt somit zwei Enantiomere, die (R)-Form und die (S)-Form, von denen nur das (S)-Enantiomer pharmakologisch aktiv ist.[7] Die Handelspräparate enthalten den Arzneistoff als Racemat (1:1-Gemisch der Enantiomere).
Herstellung
Für Vigabatrin sind in der Literatur mehrstufige Synthesen, ausgehend von Malonsäurediethylester und 1,4-Dichlor-2-buten, beschrieben.[8]
Einzelnachweise
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 1715–1716, ISBN 978-0-911910-00-1.
- Datenblatt Vigabatrin bei Sigma-Aldrich, abgerufen am 25. April 2011 (PDF).
- B. Lippert, B.W. Metcalf, M.J. Jung, P. Casara: 4-aminohex-5-enoic acid, a selective catalytic inhibitor of 4-aminobutyrate aminotransferase in mammalian brain. In: European Journal of Biochemistry, 1977, Nr. 74, S. 441. doi:10.1111/j.1432-1033.1977.tb11410.x
- Kigabeq - Opinion. EMA, Pressemitteilung, 26. Juli 2018; abgerufen am 5. August 2018.
- Meeting highlights from the Committee for Medicinal Products for Human Use (CHMP) 23.-26. Juli 2018. EMA, Pressemitteilung, 27. Juli 2018; abgerufen am 5. August 2018.
- Kigabeq (vigabatrin). (PDF) European Medicines Agency; abgerufen am 18. August 2020
- K. D. Hägele, P. J. Schechter: Kinetics of the enantiomers of vigabatrin after an oral dose of the racemate or the active S-enantiomer. In: Clinical Pharmacology and Therapy, 40, 1986, S. 581–586.
- Axel Kleemann, Jürgen Engel, Bernd Kutscher, Dietmar Reichert: Pharmaceutical Substances. 4. Auflage, Thieme-Verlag, Stuttgart 2000, ISBN 978-1-58890-031-9.