Trimipramin
Trimipramin ist ein Dibenzazepin, welches als Arzneistoff aus der Gruppe der trizyklischen Antidepressiva verwendet wird. Seine Wirkung ist stark dämpfend und angstlösend.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
-Trimipramine_Enantiomers_Structural_Formulae.png.webp) | ||||||||||||||||||||||
| 1:1-Gemisch (Racemat) aus (R)-Form (links) und (S)-Form (rechts) | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Trimipramin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C20H26N2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
N06AA06 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus |
Blockiert Serotonin-, Dopamin- und α-Adrenozeptoren | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 294,43 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt |
45 °C[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Wirkung
Trimipramin blockiert im Zentralnervensystem verschiedene Serotonin-, Dopamin- und α-Adrenozeptoren. Die Monoamin-Rückaufnahme aus dem synaptischen Spalt in die präsynaptischen Vesikel wird nur gering verzögert.[4] Somit ist der antidepressive Wirkmechanismus anders als der anderer trizyklischer Antidepressiva. Außerdem wirkt Trimipramin anticholinerg und antihistaminerg; es hat folglich auch die charakteristischen Begleit- und Nebenwirkungen der übrigen trizyklischen Antidepressiva. Trimipramin wirkt zudem als FIASMA (funktioneller Hemmer der sauren Sphingomyelinase).[5]
Aufgrund der vergleichsweise geringeren Beeinflussung von Serotonin und Noradrenalin sind die antidepressiven Effekte weniger ausgeprägt. Daher findet es vor allem bei ängstlich-agitierten Depressionen mit Unruhe, Ängstlichkeit, Schlaf-Wach-Rhythmus-Störungen, aber auch zur Behandlung von monosymptomatischen Schlafstörungen seinen Einsatz. Die sedierende Wirkung kann sehr stark sein; aus diesem Grund wird die Tagesdosis hauptsächlich abends eingenommen. Tagesmüdigkeit tritt dennoch fast immer auf, besonders zu Einnahmebeginn.
Die Halbwertszeit von Trimipramin im menschlichen Körper beträgt 24 Stunden.[6]
Indikationen
Trimipramin ist angezeigt zur Therapie von Depressionen, vornehmlich wenn Angst und Schlafstörungen als Symptome im Vordergrund stehen.
Es kann in niedriger Dosis auch adjuvant zur Behandlung chronischer Schmerzen eingesetzt werden.
Gegenanzeigen
Trimipramin darf nicht eingenommen werden
- bei akuter Alkohol-, Hypnotika-, Analgetika- und Psychopharmakaintoxikation,
- bei akuten Delirien,
- bei unbehandeltem Engwinkelglaukom,
- bei Harnentleerungsstörungen wie Harnverhalt oder Prostatahyperplasie mit Restharnbildung,
- bei Pylorusstenose,
- bei paralytischem Ileus,
- bei gleichzeitiger Einnahme von irreversiblen MAO-Hemmern,
- in der Schwangerschaft und Stillzeit.[7]
Unerwünschte Wirkungen
Trimipramin kann aufgrund der auch für andere trizyklische Antidepressiva typischen anticholinergen Wirkungen vor allem vegetative Nebenwirkungen (Mundtrockenheit, Hypotonie, Tachykardie, Mydriasis und Akkommodationsstörungen, Magen-Darm-Probleme, Miktionsstörungen usw.) haben.
Außerdem können Blutbildveränderungen (Leukopenie, Agranulozytose) auftreten, ferner Gewichtszunahme (vorwiegend durch Wassereinlagerung) sowie Stimmungsschwankungen und extrapyramidale Störungen (Tremor, Ataxie, Akathisie und Dyskinesien).
Absetzproblematik
Nach längerer Behandlung kann abruptes Absetzen zu Übelkeit, Kopfschmerzen und Unwohlsein führen.[8] Außerdem können Schlafstörungen, Angst, Unruhe und erhöhte Reizbarkeit auftreten. Die Behandlung ist schrittweise zu beenden.[9]
Anwendung in der Schwangerschaft
Trimipramin darf in der Schwangerschaft und Stillzeit nicht angewendet werden, da keine ausreichenden Erfahrungen dafür vorliegen und begrenzte Untersuchungen an Tieren Hinweise auf Schädigungen der Nachkommenschaft (erhöhte Sterblichkeitsrate und Missbildungen) gezeigt haben.[7]
Genotoxisches Potential
In Versuchen an der Fliegengattung Drosophila führte Trimipramin zu Erbgutschäden. Nach einer Studie erhöht die Einnahme von Trimipramin möglicherweise das Brustkrebsrisiko.[10]
Herstellung und Stereochemie
Die Synthese erfolgt ausgehend von 10,11,Dihydro-5H-dibenzo[b,f]azepin durch dessen Deprotonierung mit Natriumamid und eine nachfolgende nucleophile Substitution mit racemischem 3-N,N-Dimethylamino-2-methylpropylchlorid.[3]
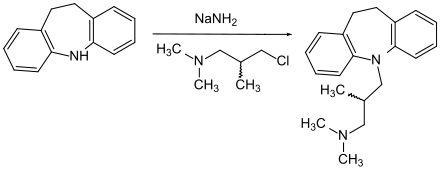
Trimipramin enthält ein Stereozentrum, der Arzneistoff wird als Racemat eingesetzt.[11]
Einzelnachweise
- Eintrag zu Trimipramine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Datenblatt Trimipramine maleate salt bei Sigma-Aldrich, abgerufen am 12. November 2021 (PDF).
- Axel Kleemann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances - Synthesis, Patents, Applications. 4. Auflage. Thieme-Verlag, Stuttgart 2000, ISBN 978-1-58890-031-9.
- B. L. Roth, J. Duriscol: PDSP Ki Database. Psychoactive Drug Screening Program (PDSP). University of North Carolina at Chapel Hill and the United States National Institute of Mental Health. 12. Januar 2011, abgerufen am 30. November 2013.
- J. Kornhuber, P. Tripal und andere: Identification of novel functional inhibitors of acid sphingomyelinase. In: PLoS ONE. 6, Nr. 8, 2011, S. e23852. doi:10.1371/journal.pone.0023852.
- Frank Block: Kompendium der neurologischen Pharmakotherapie. Springer Verlag, Heidelberg 2008, ISBN 978-3-540-31348-9, S. 436 (eingeschränkte Vorschau in der Google-Buchsuche).
- Deutsche Fachinformation: Stangyl; Stand: März 2006.
- Fachinformationen des Arzneimittelkompendiums der Schweiz: Trimin, Stand: November 2003.
- Deutsche Fachinformation: Stangyl; Stand: Juni 2008.
- C. R. Sharpe, J. P. Collet, E. Belzile, J. A. Hanley, J. F. Boivin: The effects of tricyclic antidepressants on breast cancer risk. In: British Journal of Cancer. Band 86, Nummer 1, Januar 2002, S. 92–97, doi:10.1038/sj.bjc.6600013, PMID 11857018, PMC 2746543 (freier Volltext).
- E. J. Ariëns: Stereochemistry, a basis for sophisticated nonsense in pharmacokinetics and clinical pharmacology. In: European Journal of Clinical Pharmacology. Band 26, 1984, S. 663–668; doi:10.1007/BF00541922.