Triadimefon
Triadimefon ist ein 1:1-Gemisch (Racemat) von zwei stereoisomeren chemischen Verbindungen aus der Gruppe der Triazole und Conazole.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
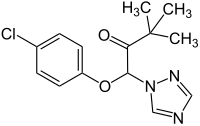 | |||||||||||||||||||
| Strukturformel mit undefinierter Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Triadimefon | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C14H16ClN3O2 | ||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff mit charakteristischem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 293,75 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,22 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Stereoisomerie
Triadimefon ist chiral, enthält also ein Stereozentrum. Es gibt somit zwei Stereoisomere, das (R)-Enantiomer und das (S)-Enantiomer. Das 1:1-Gemisch (Racemat) aus (R)- und (S)-Enantiomer nennt man (RS)-Triadimefon oder (±)-Triadimefon. Wenn in der wissenschaftlichen Literatur oder in diesem Artikel ohne weitere Detailangaben „Triadimefon“ erwähnt wird, ist das Racemat gemeint.
-_%2526_(S)-Triadimefon.svg.png.webp)
Gewinnung und Darstellung
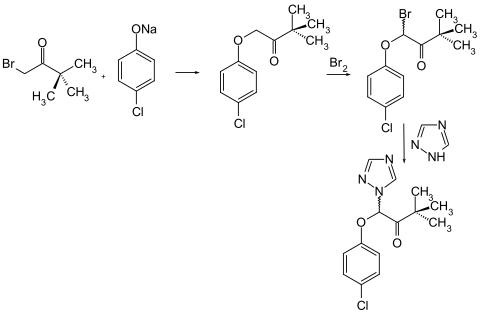
Triadimefon kann durch Dichlorierung von Pinakolon und anschließende Substitution mit Natrium-p-chlorphenolat und Triazol hergestellt werden.[1]
Ebenfalls möglich ist die Synthese durch Reaktion von Brompinacolon mit dem Natriumsalz von p-Chlorphenol und Reaktion des jeweiligen Zwischenproduktes mit Brom und 1,2,4-Triazol.[5]
Eigenschaften
Triadimefon ist ein farbloser Feststoff mit charakteristischem Geruch, der praktisch unlöslich in Wasser ist. Er ist mäßig löslich in den meisten organischen Lösungsmitteln außer Aliphaten.[1] Als Hauptabbauprodukt entsteht Triadimenol.[6] Gegenüber Hydrolyse ist es stabil in einem weiten pH-Wert-Bereich.[7] Der Metabolismus von Triadimefon verläuft enantioselektiv, d. h., (R)- und (S)-Enantiomer werden in unterschiedlicher Rate verstoffwechselt.[8]
Verwendung
Triadimefon wird als Fungizid verwendet. Es wird bei Getreide, Kaffee, Obst, Trauben, Tee, Rasen und Gemüse eingesetzt und ist in mehr als 70 Ländern zugelassen. Die Wirkung beruht auf der Beeinflussung der Sterol-Biosynthese (Steroid-Demethylierung[7]) in den Zellmembranen.
Zulassung
In der BRD war Triadimefon zwischen 1976 und 2003, in der DDR zwischen 1980 und 1994 zugelassen.[9]
Die EU-Kommission entschied 2004, Triadimefon nicht in die Liste der zulässigen Pflanzenschutzmittel-Wirkstoffe nach der Richtlinie 91/414/EWG aufzunehmen.[10]
In Deutschland, Österreich und der Schweiz sind keine Pflanzenschutzmittel mit diesem Wirkstoff zugelassen.[11]
Einzelnachweise
- Eintrag zu Triadimefon in der Hazardous Substances Data Bank, abgerufen am 17. September 2012 (online auf PubChem).
- Eintrag zu Triadimefon in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- Müller, F.; Ackermann, P.; Margot, P.: Fungicides, Agricultural, 2. Individual Fungicides in Ullmanns Enzyklopädie der Technischen Chemie, 2012 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, doi:10.1002/14356007.o12_o06.
- Eintrag zu 1-(4-chlorophenoxy)-3,3-dimethyl-1-(1,2,4-triazol-1-yl)butanone im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Thomas A. Unger: Pesticide Synthesis Handbook. William Andrew, 1996, ISBN 0-8155-1853-6, S. 722 (englisch, eingeschränkte Vorschau in der Google-Buchsuche).
- EPA: Reregistration Eligibility Decision for Triadimefon (PDF; 2,9 MB).
- Terry R. Roberts, David H. Hutson, Philip W. Lee, Peter H. Nicholls: Metabolic Pathways of Agrochemicals: Part 2: Insecticides and Fungicides. Royal Society of Chemistry, 1999, ISBN 0-85404-499-X, S. 1090 (englisch, eingeschränkte Vorschau in der Google-Buchsuche).
- A. H. B. Deas, G. A. Carter, T. Clark, D. R. Clifford, C. S. James: The enantiomeric composition of triadimenol produced during metabolism of triadimefon by fungi: III. Relationship with sensitivity to triadimefon, Pesticide Biochemistry and Physiology 26, 1986, S. 10–21.
- Peter Brandt: Berichte zu Pflanzenschutzmitteln 2009: Wirkstoffe in Pflanzenschutzmitteln. Zulassungshistorie und Regelungen der Pflanzenschutz-Anwendungsverordnung. Springer DE, 2010, ISBN 3-0348-0028-2, S. 27 (eingeschränkte Vorschau in der Google-Buchsuche).
- Entscheidung der Kommission vom 30. Januar 2004 über die Nichtaufnahme bestimmter Wirkstoffe in Anhang I der Richtlinie 91/414/EWG des Rates sowie den Widerruf der Zulassungen für Pflanzenschutzmittel mit diesen Wirkstoffen (2004/129/EG).
- Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: Eintrag zu Triadimefon in der EU-Pestiziddatenbank; Eintrag in den nationalen Pflanzenschutzmittelverzeichnissen der Schweiz, Österreichs und Deutschlands, abgerufen am 25. Februar 2016.

