Trögersche Base
Die Trögersche Base ist eine nach ihrem Entdecker, dem Chemiker Julius Tröger (1862–1942), benannte heterocyclische Verbindung, die der organischen Chemie zugerechnet wird.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
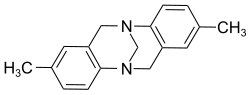 | |||||||||||||||||||
| Struktur ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Trögersche Base | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C17H18N2 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 250,34 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Struktur
Die Trögersche Base enthält zwei pyramidale Stickstoffatome, die Stereozentren bilden. In der Regel verläuft die Inversion pyramidaler Stickstoffatome mit drei verschiedenen Resten (und einem freien Elektronenpaar) sehr schnell, so dass derartige Stoffe schnell racemisieren – nicht so die Trögersche Base. In der Trögerschen Base stehen beide Stickstoffatome in einer Brückenkopfstellung, eine pyramidale Inversion ist damit unmöglich.[2] Deshalb gibt es von der Trögerschen Base zwei stabile Enantiomere, die beispielsweise chromatographisch an einer chiralen stationären Phase getrennt werden können.[3]
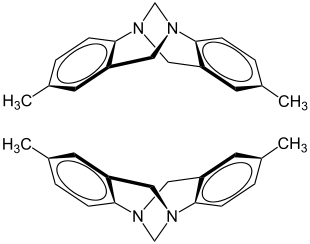
Die beiden Enantiomere der Trögerschen Base:
(5S,11S)-(–)-Form (oben) und (5R,11R)-(+)-Form (unten).
Herstellung
Die Trögersche Base wurde erstmals 1887 ausgehend von p-Toluidin und Formaldehyd in saurer Lösung synthetisiert.[4] Erst 1935 wurde die korrekte Strukturformel ermittelt.[5] Die Trögersche Base kann auch aus p-Toluidin, Dimethylsulfoxid (DMSO) und Salzsäure[6] oder p-Toluidin und Urotropin (Hexamethylentetramin)[7] hergestellt werden. Alle diese Synthesemethoden führen zum Racemat der Trögerschen Base.
Einzelnachweise
- Datenblatt Trögersche Base bei Sigma-Aldrich, abgerufen am 11. Juli 2011 (PDF).
- Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 96, ISBN 3-342-00280-8.
- Ernest L. Eliel, Samuel H. Wilen: Stereochemistry of Organic Compounds, John Wiles & Sons, 1994, S. 360, ISBN 0-471-05446-1.
- Julius Tröger: Ueber einige mittelst nascirenden Formaldehydes entstehende Basen. In: Journal für Praktische Chemie. 36, 1887, S. 225–245, doi:10.1002/prac.18870360123.
- M. A. Spielman: The Structure of Troeger's Base. In: Journal of the American Chemical Society 57, 1935, S. 583–585, doi:10.1021/ja01306a060.
- Zhong Li, Xiaoyong Xu, Yanqing Peng, Zhaoxing Jiang, Chuanyong Ding, Xuhong Qian: An Unusual Synthesis of Troeger's Bases Using DMSO/HCl as Formaldehyde Equivalent. In: Synthesis 2005, S. 1228–1230, doi:10.1055/s-2005-861868.
- Thierry Masa, Carmen Pardo, José Elguero: A shorter synthesis of symmetrical 2,11-dimethyl-bis-Tröger's bases. A new molecular tweezer. In: Arkivoc. 2004, (EM-973K).
