Thiiran
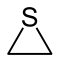
Thiiran, auch Ethylensulfid genannt, ist ein schwefelhaltiger gesättigter dreigliedriger Heterocyclus und damit der einfachste Vertreter der Stoffgruppe der Thiirane.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Thiiran | |||||||||||||||
| Andere Namen |
Ethylensulfid | |||||||||||||||
| Summenformel | C2H4S | |||||||||||||||
| Kurzbeschreibung |
klare farblose Flüssigkeit mit unangenehmem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 60,12 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,01 g·cm−3[1] | |||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| Brechungsindex |
1,495 (20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
51,6 kJ/mol[2] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Darstellung
Die Darstellung von Thiiran gelingt durch die Umsetzung von Ethylenoxid mit Thioharnstoff in wässrigem Medium unter Kühlung. Hierbei entstehen Thiiran und Harnstoff.[3]
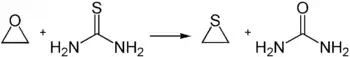
Eine weitere Möglichkeit ist die Reaktion von Ethylencarbonat mit Kaliumthiocyanat, bei der neben Thiiran Kohlenstoffdioxid und Kaliumcyanat entstehen.
Eigenschaften
Ethylensulfid ist eine bei Raumtemperatur flüssige Verbindung mit einem Siedepunkt bei 55–56 °C. Die Bindungslänge zwischen Kohlenstoff und Schwefel beträgt 181,9 pm, zwischen zwei Kohlenstoffen 149,2 pm. Der Bindungswinkel am Schwefelatom beträgt 65°48'.[4]
Reaktionen
Thiiran reagiert mit Nukleophilen unter Ringöffnung. Es kann daher zur Synthese von endständigen Thiolen eingesetzt werden. Als Nukleophile können beispielsweise Amine oder Thiole fungieren.
![]()
Mit Iminen reagiert es unter Bildung von Thiazolidinen.[5]
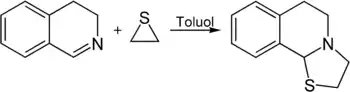
Allerdings besitzt auch das Schwefelatom des Thiirans die Möglichkeit selbst als Nukleophil zu dienen.
Einzelnachweise
- Datenblatt Ethylene sulfide bei Sigma-Aldrich, abgerufen am 24. April 2011 (PDF).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-22.
- J. F. Olin, F. B. Dains in: J. Am. Chem. Soc. 1930, 52, 3322–3327. doi:10.1021/ja01371a047
- G. L. Cunningham, A. W. Boyd, R. J. Myers, W. D. Gwinn in: J. Chem. Phys. 1951, 19, 6, 676–685; doi:10.1063/1.1748331.
- M. D. Rozwadowska, A. Sulima in: Tetrahedron 2001, 57, 3499–3506. doi:10.1016/S0040-4020(01)00224-1


