Thallium(I)-carbonat
Thallium(I)-carbonat ist eine anorganische chemische Verbindung des Thalliums aus der Gruppe der Carbonate.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
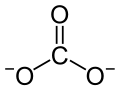 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Thallium(I)-carbonat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | Tl2CO3 | |||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 468,78 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Dichte |
7,11 g·cm−3 (25 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Thallium(I)-carbonat kann durch Reaktion einer heißen Thallium(I)-hydroxidlösung mit Kohlendioxid gewonnen werden.[1]
Eigenschaften
Thallium(I)-carbonat ist ein farbloser Feststoff, der in Form nadelförmiger Kristalle mit scharfem enantiotropem Umwandlungspunkt bei 228 °C vorliegt und löslich in Wasser ist.[1] Es ist das einzige gut in Wasser lösliche Schwermetallcarbonat.[3] Er ist nicht hygroskopisch und an Luft bis 175 °C ohne merkliche Veränderung haltbar. Seine wässrige Lösungen reagieren infolge Hydrolyse stark basisch.[1] Es schmilzt zu einer dunkelgrauen Masse.[4] Die Verbindung besitzt eine monokline Kristallstruktur mit der Raumgruppe C2/m (Raumgruppen-Nr. 12). Bei sehr hohen Drücken wird diese jedoch zerstört.[5]
Verwendung
Thallium(I)-carbonat kann zur Herstellung künstlicher Diamanten[6] und zum Test auf Kohlenstoffdisulfid[4] verwendet werden.
Einzelnachweise
- Georg Brauer, unter Mitarbeit von Marianne Baudler u. a. (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I. Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 887.
- Datenblatt Thallium(I) carbonate, ≥99.99% trace metals basis bei Sigma-Aldrich, abgerufen am 6. April 2014 (PDF).
- Erwin Riedel, Christoph Janiak: Anorganische Chemie. Walter de Gruyter, 2011, ISBN 3-11-022566-2, S. 615 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dale L. Perry: Handbook of Inorganic Compounds. CRC Press, 1995, ISBN 0-8493-8671-3, S. 406 (eingeschränkte Vorschau in der Google-Buchsuche).
- A. Grzechnik, K. Friese: Crystal structure and stability of Tl2CO3 at high pressures. In: Acta Crystallographica Section C Crystal Structure Communications. 66, 2010, S. i37–i38, doi:10.1107/S0108270110005652.
- Robert E. Krebs: The History and Use of Our Earth's Chemical Elements: A Reference Guide. Greenwood Publishing Group, 2006, ISBN 0-313-33438-2, S. 188 (eingeschränkte Vorschau in der Google-Buchsuche).


