Tetraschwefeldinitrid
Tetraschwefeldinitrid ist eine anorganische chemische Verbindung aus der Gruppe der kovalenten Nitride. Die Verbindung gehört neben dem Pentaschwefelhexanitrid, dem Tetraschwefeltetranitrid, dem Dischwefeldinitrid, dem Monoschwefelmononitrid, den Oligoschwefeldinitriden und dem polymeren Polythiazyl (SN)x zur Gruppe der Schwefel-Stickstoff-Verbindungen oder Schwefelnitride.
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
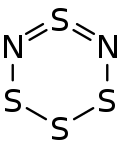 | |||||||
| Allgemeines | |||||||
| Name | Tetraschwefeldinitrid | ||||||
| Summenformel | S4N2 | ||||||
| Kurzbeschreibung | |||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 156,28 g·mol−1 | ||||||
| Aggregatzustand |
fest[3] | ||||||
| Dichte |
1,71 g·cm−3 (unterkühlte Schmelze)[2] | ||||||
| Schmelzpunkt | |||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Geschichte
Die Verbindung wurde erstmals 1897 von Wilhelm Muthmann und E. Clever hergestellt, wobei die Verbindung für ein Stickstoffpentasulfid S5N2 gehalten wurde.[5] In der frühen Literatur wurden für die Verbindung verschiedene kettenförmige und ringförmige Strukturen postuliert. Die Summenformel S4N2 konnte von A. Meuwsen 1951 mittel Kryoskopie bestimmt werden.[6] Die reale Struktur als sechsgliedriger Ring mit den Stickstoffatomen in 1- und 3-Position wurde 1971 von Henry G. Heal mittels 15N-NMR-Spektroskopie, IR-Spektroskopie, Raman-Spektroskopie, UV-VIS-Spektroskopie, Massenspektrometrie und Dipol-Messungen nachgewiesen.[7]
Gewinnung und Darstellung
Tetraschwefeldinitrid kann durch Reaktion von Tetraschwefeltetranitrid mit Schwefel bei 110 °C gewonnen werden.[3]
Ein zweiter Syntheseweg, der das explosive Tetraschwefeltetranitrid vermeidet, geht vom Heptaschwefelimid aus, das mittels Quecksilber(II)-acetat in das Quecksilbersalz überführt wird. Dieses zerfällt dann in Quecksilber(II)-sulfid, Tetraschwefeldinitrid und Schwefel.[8]
Eigenschaften
Tetraschwefeldinitrid ist ein wenig beständiger diamagnetischer dunkelroter Feststoff, der sich schon bei 0 °C innerhalb einiger Stunden zersetzt.[2] Bei 100 °C erfolgt ein explosionsartiger Zerfall zu Schwefel und Stickstoff.[2] Die Verbindung ist löslich in vielen organischen Lösungsmitteln wie z. B. Benzol, Nitrobenzol, Kohlenstoffdisulfid, Tetrachlorkohlenstoff und Diethylether, nur mäßig löslich in Alkoholen, aber unlöslich in Wasser.[3][2] Mit Wasser erfolgt eine langsame Hydrolyse, die im basischen Medium wesentlich beschleunigt wird. Gegenüber verdünnten Säuren ist die Verbindung relativ stabil.[2]
Das Tetraschwefeldinitrid-Molekül bildet einen nicht planaren sechsgliedrigen Ring in einer Halbsesselform, wobei die Atome S–N=S=N–S in einer Ebene liegen und durch ein oberhalb dieser Ebene liegendes Schwefelatom verbrückt sind.[1][9]
Mit Bortrifluorid wird ein stabiles Addukt mit der Zusammensetzung S4N2·2BF3 gebildet. Dieses beginnt sich erst oberhalb von 240 °C zu zersetzen.[2]
Einzelnachweise
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 604.
- Goehring, M.; Herb, H.; Wissemaier, H.: Über das Tetraschwefeldinitrid S4N2 in Z. anorg. allg. Chem. 267 (1952) 238–246, doi:10.1002/zaac.19522670406.
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 404.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Muthmann, W.; Clever, E.: Über das Stickstoffpentasulfid in Z. anorg. allg. Chem. 13 (1897) 200–208, doi:10.1002/zaac.18970130123.
- Meuwsen, A.: Über das Tetraschwefeldinitrid S4N2 in Z. anorg. allg. Chem. 266 (1951) 250–255, doi:10.1002/zaac.19512660409.
- Nelson, J.; Heal, H.G.: Structure of tetrasulphur dinitride in J. Chem. Soc. A, 1971, 136–139, doi:10.1039/J19710000136.
- Heal, H.G.; Ramsay, R.J.: A new, safe preparation of tetrasulphur dinitride in J. Inorg. Nucl. Chem. 37 (1975) 286, doi:10.1016/0022-1902(75)80172-2.
- Zhu, J.-K.; Gimarc, B.M.: Structure of tetrasulfur dinitride in Inorg. Chem. 22 (1983) 1996–1999, doi:10.1021/ic00156a014.