Monoschwefelmononitrid
Monoschwefelmononitrid ist eine anorganische chemische Verbindung des Schwefels aus der Gruppe der kovalenten Nitride. Die Verbindung gehört neben dem Dischwefeldinitrid, dem Tetraschwefeldinitrid, dem Pentaschwefelhexanitrid, dem Tetraschwefeltetranitrid, dem Monoschwefeldinitrid, den Oligoschwefeldinitriden und dem polymeren Polythiazyl (SN)x zur Gruppe der Schwefel-Stickstoff-Verbindungen oder Schwefelnitride. Die Verbindung ist isovalenzelektronisch mit dem Stickstoffmonoxid und somit ebenfalls ein Radikal.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
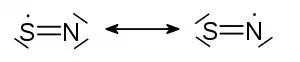 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Monoschwefelmononitrid | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | NS | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 46,07 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Es entsteht bei elektrischen Entladungen in einem Gasgemisch aus Schwefel und Stickstoff oder bei der thermischen Zersetzung von gasförmigen Tetraschwefeltetranitrid.[2][3] Im Weltraum wurde es in einer Riesenmolekülwolke und in Kometenhüllen beobachtet.[4]
Die Verbindung ist instabil und zerfällt schnell in Schwefel, Stickstoff und höhere Schwefelnitride.[2] Die Bildungsenthalpie ist mit 281 kJ·mol−1 endotherm. Die mittels IR-Spektroskopie bestimmte Bindungslänge beträgt 149,7 pm. Die Dissoziationsenergie für die S-N-Bindung beträgt 463 kJ·mol−1.[3][2]
Analog zum Stickstoffmonoxid wird durch die Abgabe eines Elektrons das Thionitrosylkation NS+ gebildet, welches in Salzen wie dem Thionitrosylhexafluorophosphat NSPF6 oder in Metallkomplexen vorkommt.[3][2][5] Verbindungen mit dem, sich durch die Aufnahme eines Elektrons ergebenden, dem Nitroxylion NO− analogen Thionitroxylion NS−, sind nicht bekannt.[2]
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Wiberg, E.; Wiberg, N.; Holleman, A.F.: Anorganische Chemie, 103. Auflage, 2017 Walter de Gruyter GmbH & Co. KG, Berlin/Boston, ISBN 978-3-11-026932-1, S. 680, (abgerufen über De Gruyter Online).
- Eintrag zu Schwefel-Stickstoff-Verbindungen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 2. März 2017.
- Canaves, M. V.; de Almeida, A. A.; Boice, D. C.; Sanzovo, G. C.: Nitrogen Sulfide in Comets Hyakutake (C/1996 B2) and Hale-Bopp (C/1995 O1) in Earth, Moon, and Planets 90 (2002) 335–347, doi:10.1023/A:1021582300423.
- Teague, C.M.; O'Brien, T.A.; O'Brien, J.F.: Theoretical Comparison of the Bonding in CpCr(CO)2(NX) [X = O, S, Se, Te] in J. Coord. Chem. 55 (2002) 627–631, doi:10.1080/00958970290027480.