Tellurwasserstoff
Tellurwasserstoff, auch Monotellan, ist eine chemische Verbindung aus Tellur und Wasserstoff und stellt ein sehr giftiges, leicht kondensierbares Gas dar.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
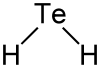 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Tellurwasserstoff | |||||||||||||||
| Andere Namen |
Monotellan | |||||||||||||||
| Summenformel | H2Te | |||||||||||||||
| Kurzbeschreibung |
farbloses Gas mit stechendem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 129,62 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte |
5,76 kg·m−3 (0 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
−1,25 °C[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Es entsteht durch elektrolytische Reduktion von Tellur an der Kathode in 50%iger Schwefelsäure oder durch Protolyse salzartiger Telluride in Säuren, wie beispielsweise bei der Umsetzung von Aluminiumtellurid mit Salzsäure:[2]
Eigenschaften
Tellurwasserstoff riecht ähnlich unangenehm knoblauchartig[3] wie Arsenwasserstoff. Das Gas ist leicht in Wasser löslich, zersetzt sich an der Luft und verbrennt mit bläulicher Flamme zu Tellurdioxid und Wasser. In Wasser bildet sich die mittelstarke und durch Oxidation unbeständige Tellurwasserstoffsäure. Die Dissoziationskonstanten pKs1 und pKs2 betragen 2,64 und 8,80.[4]

Tellurwasserstoff ist gewinkelt aufgebaut (Bindungswinkel 89,5°), die Bindungslänge Te–H beträgt jeweils 169 pm.[5]
Weblinks
- Eintrag zu Tellurwasserstoff. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD
Einzelnachweise
- Eintrag zu Tellurwasserstoff in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- G. Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry, 2nd ed., vol. 1, Academic Press 1963, S. 439–441.
- Wolfgang Legrum: Riechstoffe, zwischen Gestank und Duft, Vieweg + Teubner Verlag (2011) S. 74, ISBN 978-3-8348-1245-2.
- D'Ans-Lax, Taschenbuch für Chemiker und Physiker, 4. Auflage, Band 3, Springer Verlag 1998, ISBN 3-540-60035-3.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 627.


