Sulfurylchloridfluorid
Sulfurylchloridfluorid ist eine anorganische chemische Verbindung aus der Gruppe der Säurechloride und Säurefluoride.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
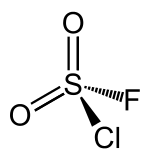 | ||||||||||||||||
| Keile zur Verdeutlichung der räumlichen Struktur | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Sulfurylchloridfluorid | |||||||||||||||
| Andere Namen |
Sulfurylfluoridchlorid | |||||||||||||||
| Summenformel | ClFO2S | |||||||||||||||
| Kurzbeschreibung |
farbloses, stechend riechendes Gas[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 118,52 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig[2] | |||||||||||||||
| Dichte |
1,623 g·cm−3 (0 °C)[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
7,1 °C[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Sulfurylchloridfluorid kann durch Reaktion von Sulfurylchlorid mit Antimon(III)-fluorid und Antimon(V)-chlorid als Katalysator bei 300 °C und Überdruck gewonnen werden.[1]
Ebenfalls möglich ist die Darstellung durch Reaktion von Sulfurylchlorid mit Natriumfluorid bei 80 °C.[1]
Eigenschaften
Sulfurylchloridfluorid ist ein farbloses, stechend riechendes Gas. An Luft raucht es nicht und reagiert mit Wasser und Alkalilauge rasch. Es greift Glas, Quecksilber und Messing nicht an.[2]
Verwendung
Sulfurylchloridfluorid wird bei der Herstellung von neuartigen fluorierten Alkansulfonyloxaziridinen und bei der Alkoxylierung von Fullerenen verwendet.[2] Es wird auch als Lösungsmittel verwendet.[4]
Einzelnachweise
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 191.
- Datenblatt Sulfuryl chloride fluoride, technical grade, ≥90% bei Sigma-Aldrich, abgerufen am 20. September 2013 (PDF).
- Richard J. Lewis, Sr.: Hazardous Chemicals Desk Reference. John Wiley & Sons, 2008, ISBN 0-470-33445-2, S. 1295 (eingeschränkte Vorschau in der Google-Buchsuche).
- Jeffrey W. Schubert: The Structure of Bromonium, Chloronium, and Oxonium Ions. ProQuest, 2008, ISBN 0-549-46764-5, S. 22 (eingeschränkte Vorschau in der Google-Buchsuche).

