Rubidiumhydrogencarbonat
Rubidiumhydrogencarbonat ist ein Rubidiumsalz der Kohlensäure.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
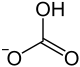 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Rubidiumhydrogencarbonat | ||||||||||||
| Summenformel | RbHCO3 | ||||||||||||
| Kurzbeschreibung |
farblose Kristalle[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 146,48 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Herstellung
Rubidiumhydrogencarbonat kann durch Einleiten von Kohlendioxid in eine wässrige Lösung von Rubidiumcarbonat hergestellt werden.[4]
Eine weitere Synthese geht von Rubidiumhydroxid und Dimethylcarbonat aus und ergibt durch Hydrolyse des intermediär entstehenden Rubidiummonomethylcarbonats das gewünschte Produkt.[5]
Eigenschaften
Physikalische Eigenschaften
Rubidiumhydrogencarbonat kristallisiert im monoklinen Kristallsystem in der Raumgruppe C2/m (Raumgruppen-Nr. 12) mit den Gitterparametern a = 1473,5 pm, b = 582,02 pm, c = 403,67 pm und β = 104,408°. In der Elementarzelle befinden sich 4 Formeleinheiten.[5] Es liegt bei Raumtemperatur als Dimer vor,[6] zwei Hydrogencarbonationen bilden über eine Wasserstoffbrückenbindung ein komplexes Anion [H2C2O6]2−.[7][8] Bei 245 K findet ein Phasenübergang statt,[9] die Tieftemperaturphase kristallisiert im triklinen Kristallsystem.[10]
Rubidiumhydrogencarbonat bildet mit Kaliumhydrogencarbonat Mischkristalle.[5]
Chemische Eigenschaften
Beim Erhitzen zersetzt sich Rubidiumhydrogencarbonat unter Abgabe von Kohlendioxid.[4]
Beim langsamen Eindampfen einer Lösung von Rubidumhydrogencarbonat mit Rubidiumperiodat entsteht Rubidiumorthoperiodat.[11]
Einzelnachweise
- Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-5406-0035-0, S. 684f. (eingeschränkte Vorschau in der Google-Buchsuche).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. CRC Press, 2009, ISBN 978-1-4200-9084-0.
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von Rubidium hydrogen carbonate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 29. Juli 2019.
- R. Abegg, F. Auerbach: "Handbuch der anorganischen Chemie". Verlag S. Hirzel, Bd. 2, 1908. S. 435.Volltext
- Dissertation: "Beiträge zur Kristallchemie der Alkalimetallcarbonate und -hydrogencarbonate", Vytas Cirpus, Universität Köln 1997. PDF
- G. A. Webb, C. J. Jameson, H. Fukui, K. Kamienska-Trela: "Nuclear Magnetic Resonance", Verlag Royal Society of Chemistry, 2005, ISBN 9780854043521, S. 311. (eingeschränkte Vorschau in der Google-Buchsuche)
- Moon Il Kim: "The Crystal Structure of Rubidium Hydrogen Carbonate (RbHCO3)" in Journal of the Korean Chemical Society 1969, 13(2), S. 131–136. Abstract
- C. Larvor, B. Stöger: The phase transition of rubidium hydrogen carbonate, RbHCO3. In: Acta Crystallographica, E73, 2017, S. 975–979, doi:10.1107/S2056989017008271.
- C. Odin: "Evidence of a phase transition of RbHCO3 from high-resolution solid-state 13C and 87Rb NMR by comparison with KHCO3." in Magn. Reson. Chem 2004, 42(4), S. 381–388 (PMID 15022199).
- R. Müller, G. Roth: "Matrix-free integration of image-plate diffraction data" in J. Appl. Cryst 2005, 38, S. 280–290. doi:10.1107/S0021889804034089
- G. V. Shilov, Z. K. Nikitina, Yu. A. Dobrovol'skii, L. S. Leonova, L. O. Atovmyan: "Disubstituted Rubidium Orthoperiodate Rb2H3IO6: Crystal and Molecular Structures and Properties" in Russian Journal of Coordination Chemistry 2004, 30(7), S. 449–452. doi:10.1023/B:RUCO.0000034783.23782.8d