Rosskastanienminiermotte
Die Rosskastanienminiermotte (Cameraria ohridella), auch Balkan-Miniermotte genannt, ist ein Kleinschmetterling aus der Familie der Miniermotten (Gracillariidae). Die Raupen und Puppen entwickeln sich fast ausschließlich in den Blättern der weißblühenden Gewöhnlichen Rosskastanie (Aesculus hippocastanum). Sie hat durch die extrem schnelle Verbreitung von ihrem Ursprungsgebiet in inzwischen fast alle Gebiete Europas hinein großes öffentliches und publizistisches Aufsehen erregt.
| Rosskastanienminiermotte | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Rosskastanienminiermotte (Cameraria ohridella) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Cameraria ohridella | ||||||||||||
| Deschka & Dimić, 1986 |
Die Rosskastanienminiermotte wurde erstmals 1984 in Mazedonien in der Nähe des Ohridsees entdeckt. 1989 wurde sie in Österreich (im Raum von Linz und Steyr[1]) erstmals nachgewiesen[2] (eine erste Massenvermehrung fand hier bereits 1990/91 statt[3]). Seither breitet sie sich sehr schnell weiter in Mitteleuropa, sowohl nach Osten als auch nach Westen, aus. Ihre extrem schnelle Vermehrung ist dadurch zu erklären, dass die Art in Mitteleuropa nur wenige natürliche Feinde hat bzw. dass sich mögliche Fressfeinde diese neue Nische noch nicht erschlossen haben. Bei den mitteleuropäischen Populationen ist zudem (bisher?) der Parasitierungsgrad noch gering.
Das Ursprungsgebiet der Art wurde zunächst kontrovers diskutiert, da die meisten nahe verwandten Arten ausschließlich in Nordamerika vorkommen. Im Nachhinein konnten aber Funde auf einem Herbarbeleg nachgewiesen werden, der 1879 in Griechenland gesammelt worden war.[4][5] Das Ursprungsgebiet sind tiefe, auch heute noch schwer zugängliche Schluchten und Täler in Albanien, Nordgriechenland und Makedonien, wo die Gewöhnliche Rosskastanie heute noch natürlich vorkommt.
Merkmale
Falter
Der Falter hat eine Körperlänge von 2,28 bis 3,04 mm (Mittel 2,65 mm) und eine Flügelspannweite von 5,92 bis 7,5 mm (6,63 mm). Die Vorderflügel sind metallisch-glänzend rot, rotbraun, kastanienbraun oder orangebraun. Im Basalfeld befindet sich ein weißer Längsstrich. Im Mittel- und Außenfeld sind vier weißliche, schwarz gefasste, meist unterbrochene Querbänder. Die Hinterflügel sind dunkelgrau. Auffällig sind die langen Fransen am äußeren Ende der Hinterflügel, die dem Hinterende des Falter ein federartiges Aussehen geben. Die Art besitzt lange schwarz-weiß geringelte Fühler, die etwa 4/5 der Vorderflügellänge entsprechen. Der Kopf weist Büschel orangefarbener Haare auf. Die Beine sind schwarz-weiß geringelt. Der Saugrüssel ist gut entwickelt.
Ei
Die Eier sind weißlich, abgeflacht, elliptisch und durchscheinend. Sie sind 0,12 bis 0,34 mm (Mittel 0,27) breit und 0,24 bis 0,5 mm (Mittel 0,37) lang.
Raupe
Die Entwicklung verläuft über sechs, gelegentlich sieben Larvenstadien: vier bis fünf Larvenstadien (L1 bis L4/L5) die fressen, und zwei sogenannte Präpupa- oder Spinnstadien (S1, S2), die nicht mehr fressen. Von den beiden letzteren lebt das erste Stadium noch außerhalb des Kokons, das zweite Stadium innerhalb eines Kokons. Die Eiraupen und die L2 bis L4/L5 sind abgeplattet, sie besitzen keine Beine. Die Mandibeln sind nach vorne gerichtet, die Kopfkapsel ist keilförmig. Es sind 13 Körpersegmente vorhanden, die seitlich etwas eingeschnürt sind. Jedes Segment weist einige Setae auf. Auf dem Rücken sind einige braune Striae vorhanden. Der Körper ist durchscheinend, sodass der Verdauungsapparat und andere Organe zu sehen sind. In den Spinnstadien ist der Kopf rundlich und es ist eine Spinndrüse ausgebildet. Der Körper des ersten Spinnstadiums ist grau. Das zweite Spinnstadium besitzt einen blassgelben bis cremefarbenen Körper. Länge: bis zu 5,5 mm.
Puppe
Die Puppe ist 3,25 bis 3,7 mm lang bei einem Durchmesser von 0,7 bis 0,8 mm. Sie ist orange, hellbraun bis dunkelbraun. Die Flügelhüllen sind lang, die Antennenhüllen erreichen fast die Spitze des Abdomens. Sie hat keinen Kremaster. Sie besitzt aber einen zugespitzten Kopf. Ein charakteristisches Merkmal der Puppe der Rosskastanienminiermotte ist, dass das zweite bis sechste Abdomensegment je ein Paar nach innen gekrümmte Dornen aufweist, die vermutlich der Verankerung im Kokon oder der Verankerung des Kokons an der oberen Blattepidermis während des Schlupfs dienen. Die Puppen weisen einen Sexualdimorphismus auf; bei den Männchen sind die sechsten und siebten Abdominalsegmente etwas länger; das siebte Segment ist zudem etwas breiter.[6]
Der haploide Chromosomensatz ist 30.[7]
Ähnliche Arten
Die nächstverwandte Art der Rosskastanienminiermotte lebt vermutlich in Japan. Die auf Kyūshū und im Süden von Hokkaidō gefundene „Cameraria niphonica Kumata 1963“ unterscheidet sich von der europäischen Art nur wenig im Genitalapparat.[8] Sie befällt drei Arten von Ahornen. Die große Mehrzahl der Cameraria-Arten lebt in Nordamerika, wo sie unterschiedliche Pflanzenfamilien befallen. In Nordamerika befällt lediglich eine Art der Gattung Cameraria, Cameraria aesculisella, Baumarten der Gattung Aesculus.[9] Sie unterscheidet sich aber deutlich von der Rosskastanienminiermotte.
Geographische Verbreitung
Das ursprüngliche Verbreitungsgebiet der Rosskastanienminiermotte sind Bestände der Gewöhnlichen Rosskastanie (Aesculus hippocastneum L.) in Albanien, Mazedonien, Nord- und Mittelgriechenland und wahrscheinlich auch in Ostbulgarien.[5] Dies ergab sich nach Untersuchungen an Herbarbelegen der Gewöhnlichen Rosskastanie aus zahlreichen Herbarien, die bis 1879 zurückreichen. Eine weitere Bestätigung der Herkunft der Rosskastanienminiermotte vom südlichen Balkan und Griechenland ist in der genetischen Diversität der Populationen zu finden. Romain Valade et al. fanden 2009 25 verschiedene Haplotypen (A–Z) der Rosskastanienminiermotte in den natürlichen Beständen der Gewöhnlichen Rosskastanie. Im derzeitigen Ausbreitungsgebiet fanden sie dagegen nur drei Haplotypen (A, B, C), wobei zudem der Haplotyp A stark dominierte.[10] Weitere unterschiedliche Haplotypen fanden David Lees et al. 2011 bei der Untersuchung des Herbarmaterials in Griechenland.[5] Die genetische Diversität der Populationen der Rosskastanienminiermotte in Mitteleuropa ist gegenüber der Ursprungspopulation stark reduziert, da sie nur auf wenige Exemplare zurückgehen (Gründerpopulation), die Ende der 1980er Jahre nach Österreich eingeschleppt worden sind.
Obwohl die Falter flugfähig sind, fliegen sie aktiv nur kurze Strecken. Der leichte Körperbau und die fransigen Hinterflügel ermöglichen ein passives Fliegen und die Verbreitung durch den Wind. Daneben wird die Miniermotte vom Menschen über Reise- und Transportwege verbreitet.[11]
Ausbreitung seit 1984
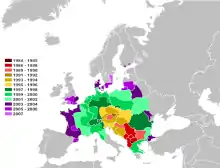
Die Rosskastanienminiermotte wurde erstmals 1984 in Mazedonien in der Nähe des Ohridsees entdeckt. Sie wurde 1986 erstmals beschrieben. Einer der Autoren der Erstbeschreibung, G. Deschka, brachte damals auch Proben aus Mazedonien mit nach Linz. 1989 wurde sie in Österreich (im Raum von Linz und Steyr[1]) erstmals nachgewiesen[2] (eine erste Massenvermehrung fand hier bereits 1990/91 statt[3]). Es ist nicht ausgeschlossen, dass einige Tiere aus den Zuchten in Linz entkommen sind und so einen Sprung von 1000 km in Richtung Mitteleuropa machen konnten.
Seither breitet sich die Rosskastanienminiermotte mit einer Geschwindigkeit von etwa 40 bis 100 km pro Jahr über Europa aus. 2002 hatte sie im Westen die Iberische Halbinsel und die Britischen Inseln erreicht, es wurde ein erster Befall der Gewöhnlichen Rosskastanie (Aesculus hippostaneum) in Wimbledon (Südengland) festgestellt. 2010 war auf den Britischen Inseln bereits die schottische Grenze erreicht.[12] Im Norden ist sie bereits nach Südskandinavien vorgedrungen. Im Osten hatte sie spätestens bis 2002 Moldawien, die Ukraine, Weißrussland und das westliche Russland erreicht. Im Südosten wurden 2002 ebenso erste Fälle von Massenbefall auch aus der Türkei berichtet.[13]
Lebensweise
Die Rosskastanienminiermotte bildet in Mitteleuropa meistens drei aufeinanderfolgende Generationen pro Jahr, die im April/Mai, Juli und Mitte August bis Ende September fliegen.[14] Allerdings wurden unter für die Art günstigen Wetterbedingungen, warm und trocken, schon bis zu fünf sich überlappende Generationen beobachtet. Oft wird aber schon die vierte Generation nur unvollständig ausgebildet, da keine frischen Blätter mehr zur Verfügung stehen.
Die ersten Falter schlüpfen nach der Winterdiapause je nach Region ab etwa Mitte April, unter günstigen Bedingungen etwa in Norditalien auch schon Ende März. Wetterbedingt kann sich auch in derselben Region der Schlupf der ersten Falter um ein oder zwei Wochen verzögern. Der Kopf der Puppe besitzt einen ausgeprägten schnabelartigen Vorsprung, der zum Öffnen des scheibenförmigen Kokons und dem Durchstoßen der Blattepidermis dient. Der Schlupf der Falter erfolgt ausschließlich über das Durchbrechen der oberen Blattepidermis. Die Puppenhülle bleibt in der Blattmine zurück. Das Schlüpfverhalten nach der Winterruhe ist als protandrisch i. w. S. zu bezeichnen, d. h., in den ersten 14 Tagen schlüpfen signifikant mehr Männchen, in den folgenden 14 Tagen signifikant mehr Weibchen. Insgesamt ist das Verhältnis von Männchen zu Weibchen aber in etwa gleich. Das Schlüpfen der überwinternden Generation zog sich in der Region München (Bayern) über 42 Tage hin.
Die Falter der Frühjahrsgeneration halten sich überwiegend im Unterwuchs und unteren Kronenbereich und am Stamm auf. Sie bevorzugen dabei windabgewandte und besonnte Stellen. Sie sitzen in der Regel mit dem Kopf nach oben gerichtet. Im weiteren Verlauf dringen die Weibchen zur Eiablage auch in die oberen Kronenbereiche vor. Vor allem die Falter der Sommer- und Herbstgeneration halten sich eher im Kronenbereich auf, besonders wenn die Blätter des unteren Kronenbereichs durch die Frühjahrsgeneration schon stark genutzt worden sind.
Die Weibchen locken die Männchen mit Hilfe von Pheromonen an, die von einer Duftdrüse am Hinterende produziert werden.[15] Die Kopulation folgt innerhalb weniger Tage nach dem Schlupf. Oft sind schon kurz nach dem Schlüpfen erste Paare bei der Kopulation zu beobachten. Die Falter sind tagaktiv mit Aktivitätsmaxima in der Mitte des Vormittags und etwa der Mitte des Nachmittags. Sie sind am aktivsten bei mäßig warmen Temperaturen von 20 bis 24 °C.[16]
Die Weibchen legen danach 20 bis 82 Eier einzeln an der Oberseite der Blätter ab. Bei hoher Populationsdichte der Falter wurden schon bis zu 300 Eier pro Kastanienblatt beobachtet. Die Falter haben eine Lebensdauer von 4 bis 11 Tagen. Bisher gibt es keine Beobachtungen, dass die Falter, obwohl sie eine gut entwickelte Proboscis haben, während ihres kurzen Lebens Nahrung zu sich nehmen. Die Falter treten gehäuft im Mai, Juli und August/September auf, mit einigen Nachzüglern bis Anfang Oktober.
Aus den Eiern schlüpfen nach etwa 4 bis 21 Tagen die Eiraupen, die sich direkt unter der Eihülle unter die Blattepidermis fressen. Insgesamt werden sechs, selten sieben Larvenstadien bis zur Verpuppung durchlaufen. Die Larvalphase unterteilt sich in ein Fressstadium (vier bis fünf Stadien, L1 bis L4/L5) und ein Spinnstadium (zwei Stadien, S1, S2). Die Junglarven (L1) fressen sich zunächst einen Gang von ein bis zwei mm Länge strichförmig parallel zu einer Blattader im Blatt, den sie dann seitlich weiterführen. Die obere und untere Epidermis des Blattes bleibt dabei intakt, sie „minieren“ oder bilden eine Blattmine. L1-Raupe saugt eher Säfte als dass sie Zellgewebe frisst. Ab dem zweiten Larvenstadium (L2)[17] fressen sie dann das Palisadenparenchym, jedoch ohne die Blattadern, die weitgehend intakt bleiben. Die Larven trennen bei ihrer Fraßtätigkeit die Blattoberhaut von dem darunter liegenden Blattgewebe und trennen damit die Wasserversorgung ab, wodurch die Bereiche oberhalb der Minen austrocknen und braun werden.[11][18] Die L2 erweitert die Mine zu einem kreisförmigen Gebilde von 2 bis 3 mm, die L3 auf einen Durchmesser von 5 bis 8 mm. Die nun unregelmäßig zwischen zwei Blattadern erweiterten Minen können bis zum Ende des Fressstadiums 30 bis 40 mm groß werden. Bei starkem Befall können auch so genannte Gemeinschaftsminen entstehen, in denen sich mehrere Larven entwickeln.


Am Ende des vierten (oder fünften) Larvenstadiums stellt die Larve das Fressen ein, und beginnt sich einzuspinnen. Das erste Spinnstadium (S1) spinnt nur einzelne Fäden, die einen Raum innerhalb der Mine bilden, in der sich die Raupe letztendlich verpuppt. Zunächst häutet sich das erste Spinnstadium in das letzte Larvenstadium (S2). Diese Larve kann nun zwei völlig verschiedene Verhaltensweise zeigen, entweder wird ein fester, seidener Kokon gesponnen, oder es wird kein Kokon gesponnen. Wird ein Kokon angelegt, wird er in der Blattmine an die untere Blattepidermis angeheftet; im Kokon findet in diesem Fall auch die Verpuppung statt. Die Larvalphase dauert (in der Region München) insgesamt 49 bis 63 Tage.
Die Puppe ist eine bedeckte Puppe (Pupa obtecta). Die anschließende Puppenruhe beträgt im Sommer 12 bis 16 Tage oder bei der überwinternden Generation mindestens sechs Monate.[9][19] Die Puppen der letzten Generation überwintern im Blatt. Der scheibenförmige Kokon, der aber nicht immer gebildet wird, misst rund 5 mm im Durchmesser. Allerdings überwintern nicht nur Puppen der letzten Generation des Jahres, sondern auch Puppen der 2. Generation (34,8 %) oder sogar der 1. Generation (9,78 %).[9] Diese Puppen gehen in eine echte Winterdiapause, d. h., sie brauchen einige Zeit Frosttemperaturen, damit sie im Frühjahr bei steigenden Temperaturen schlüpfen. Beispielsweise konnte eine dreiwöchige Phase mit maximalen Tagestiefsttemperaturen von −1,5 °C bis +1 °C und Tageshöchsttemperaturen von 4 bis 8 °C (unter Laborbedingungen) die Winterdiapause nicht durchbrechen. Was letztendlich diese Winterdiapause auslöst, ist unklar, da ja schon einige Puppen der ersten und zweiten Generation in die Winterdiapause fallen können. Die Puppen von Cameraria ohridella sind äußerst widerstandsfähig gegen tiefe Frosttemperaturen (im Pustertal/Südtirol bis −15/−20 °C, im Extremfall bis −28 °C). Sie ertragen die völlige Vertrocknung oder die völlige Vernässung der Blätter und sogar teilweise Verschimmelung der Blätter. Die Puppen können auch zwei oder drei Winter überliegen, d. h., erst im übernächsten oder überübernächsten Frühjahr schlüpfen.
Wirtspflanzen
Gewöhnliche Rosskastanie (Aesculus hippocastanum)
_in_Parma%252C_Italy.jpg.webp)
In ihrem ursprünglichen Verbreitungsraum im südlichen Balkan, in Albanien, Südmazedonien sowie Nord- und Mittelgriechenland stehen die Bäume der Gewöhnlichen Rosskastanie (Aesculus hippocastanum) einzeln oder in kleinen Beständen und sind bzw. waren im Allgemeinen schwer zugänglich. Deshalb blieb die Rosskastanienminiermotte auch bis 1984 unentdeckt. Auch eventuelle Massenvorkommen der Rosskastanienminiermotte wurden bis 1984 nicht registriert.
Umso erstaunlicher sind Ergebnisse aus der Untersuchung von Herbarienmaterial. So hatten getrocknete Blätter der Gewöhnlichen Rosskastanie aus Südalbanien, die 1961 gesammelt worden waren, einen Befall mit Blattminen von C. ohridella, der durchaus an den derzeitigen Befall der Blätter beim derzeitigen Massenvorkommen in Mitteleuropa heranreicht. Entweder begann das heute noch andauernde Massenauftreten der Rosskastanienminiermotte schon viel früher, oder es gab eben auch schon früher, zumindest in den 1960er Jahren, gelegentliches Massenauftreten der Motte, das aber unbemerkt geblieben ist. Herbarmaterial der Gewöhnlichen Rosskastanie aus Gebieten außerhalb des südlichen Balkans und Griechenlands war ausnahmslos nicht von der Rosskastanienminiermotte befallen. Die Ausbreitung der Rosskastanienminiermotte außerhalb des natürlichen Verbreitungsgebietes ist daher sicher neueren Datums.
Die Zugänglichkeit der ursprünglichen Bestände wurde in den letzten Jahrzehnten des 20. Jahrhunderts durch Straßenbau in vorher kaum zugänglichen Bergregionen Griechenlands stark erleichtert. Dies erleichtert aber auch eine zufällige Verschleppung der Rosskastanienminiermotte durch Fahrzeuge in diese vorher für die Motte unerreichbaren Gebiete.
Schadwirkung
In den ersten Jahrhunderten ihrer Existenz in Mitteleuropa war die Gewöhnliche Rosskastanie wenig durch Krankheiten oder Fressfeinde gefährdet. Seit den 1950er Jahren trat der Schlauchpilz Guignardia aesculi, der Erreger der Blattbräune auf. Umso überraschender war nun der Befall der Blätter durch die Rosskastanienminiermotte, die sich seit den 1990er Jahren in ganz Europa ausgebreitet hat.


Die Fraßgänge (Minen) der Larven führen zu einer schnellen Braunfärbung und damit zum langsamen Welken der Blätter schon im Sommer. Dies führt zu einer Schwächung des Baumes, da die Photosynthese unterbrochen wird. Die Bäume können weniger Nährstoffe aufnehmen. Sie verlieren auch ihre ästhetische Qualität, zumindest Monate früher als ohne Befall durch die Rosskastanienminiermotte. Bisher ist allerdings noch kein Absterben der Bäume aufgrund des Befalls durch die Rosskastanienminiermotte beobachtet worden, was anfänglich befürchtet wurde. Jedoch existieren auch noch keine Langzeiterkenntnisse über deutlich mehr als 20 Jahre. Auf längere Sicht ist eine Schwächung der Bäume zu befürchten, da sie durch das Absterben der Blätter an der Assimilation gehindert werden. Stark befallene Bäume haben im Herbst deutlich kleinere Früchte als nicht oder weniger stark befallene.
Zusätzliche negative Auswirkungen durch andere Kastanienkrankheiten könnten aber zukünftig auftreten.
Andere Rosskastanien
In Europa wird vor allem die weißblühende Gewöhnliche Rosskastanie angepflanzt. Zur farblichen Abwechslung wurden in die Bestände auch Exemplare der rotblühenden, meist aber etwas kleineren Roten Rosskastanie (Aesculus pavia) angepflanzt. Für den Laien sehr ähnlich ist die Fleischrote Rosskastanie Aesculus x carnea Hayne, eine fruchtbare Hybride aus Aesculus hippocastanum und Aesculus pavia, die sich über Samen vermehren lässt.
Die Erstbeschreiber der Rosskastanienminiermotte glaubten 1986 noch, dass die Art streng monophag an der Gewöhnlichen Rosskastanie sei. Inzwischen wurde jedoch auch Befall einer ganzen Reihe anderer Baumarten beobachtet. Unter den anderen Aesculus-Arten (und Hybriden) werden Aesculus pavia und Aesculus x carnea zwar auch befallen, die Larven entwickeln sich jedoch nicht. Einzelne Berichte von Befällen Roter und Fleischroter Rosskastanien könnten damit zusammenhängen, dass diese in Europa weitverbreiteten rotblühenden Rosskastanien in Baumschulen in aller Regel hochstämmig auf Aesculus hippocastanum veredelt werden. So können z. B. Stockausschläge oder einzelne Äste durchaus zur Unterlage gehören. Dies ist nur zur Blütezeit zu unterscheiden, wenn sich Blüten an diesen Ästen und Trieben ausbilden.
Auch andere selten angepflanzte Arten von Aesculus aus Nordamerika wie die Gelbe Rosskastanie (Aesculus flava Sol.), die Ohio-Rosskastanie (Aesculus glabra Willd.) und die Strauch-Rosskastanie (Aesculus parviflora Walt.) werden entweder von der Rosskastanienminiermotte erst gar nicht befallen oder die Larven können sich in den Blättern dieser Arten nicht entwickeln. Die asiatische Indische Rosskastanie (Aesculus indica) wird zwar stark angeflogen und mit Eiern belegt, die Larven starben aber schon im ersten Stadium ab. Dagegen wurde an der Japanischen Rosskastanie (Aesculus turbinata), Schwesterart der Gewöhnlichen Rosskastanie, zwar nur geringer Befall festgestellt, die Minen waren aber gut entwickelt.
Bergahorn
Bereits wenige Jahre nach der Invasion der Rosskastanienminiermotte nach Mitteleuropa wurde festgestellt, dass auch der Bergahorn (Acer pseudoplatanus) befallen wurde, wenn der Baum beispielsweise unter oder direkt neben einer stark befallenen Gewöhnlichen Rosskastanie stand. Zuerst dachte man, dass sich die Larven nicht weiterentwickeln, doch wurden nur wenig später auch lebende Puppen in den Blättern des Bergahorns gefunden.
Spitzahorn
Auch Spitzahorn (Acer platanoides) wird gelegentlich befallen. Allerdings wurde überall, wo Befall an Ahorn-Arten festgestellt wurde, beobachtet, dass die Sterblichkeit der Larven durch Räuber und Parasiten sehr hoch war. Die Gattung Acer ist nahe mit der Gattung Aesculus verwandt und wird heute in dieselbe Unterfamilie Hippocastanoideae gestellt. Mehrere Arten der Gattung Cameraria sind auf Arten der Gattung Acer spezialisiert.
Bekämpfung
Chemische Präparate
Zur Bekämpfung der Rosskastanienminiermotte kommt das als Chitininhibitor wirkende Präparat Dimilin (Wirkstoff: Diflubenzuron) zum Einsatz. Dimilin hat eine larvizide (Absterben der Larven) sowie eine ovizide Wirkung (verhindert das Schlüpfen der Larven). Dennoch ist es für Menschen, Haustiere, Vögel und Nutzinsekten (Bienen, Florfliegen) ungefährlich. Der beste Zeitpunkt für eine Spritzung mit Dimilin ist im April/Mai, kurz vor der Rosskastanienblüte.
Des Weiteren sind für die Bekämpfung der Rosskastanienminiermotte in Deutschland Präparate mit den Wirkstoffen Azadirachtin sowie Methoxyfenozid zugelassen.[20]
Azadirachtin ist der insektizide Wirkstoff des Niembaumes. Es hat eine teilsystemische Wirkung (wird von den behandelten Pflanzenteilen aufgenommen und erreicht so auch versteckt lebende bzw. minierende Schädlinge); es zeichnet sich durch eine ausgeprägte Fraßstoppwirkung aus und greift in das hormonelle Gleichgewicht der Schadinsekten ein, es stört die Häutung, Metamorphose und blockiert die Vermehrung der behandelten Schädlinge.[21]
Methoxyfenozid ist ein synthetischer Wirkstoff aus der Gruppe der Bisacylhydrazide. Es wirkt als ein Ecdysonagonist durch vorzeitige Einleitung der Häutung der Larven, was deren Absterben zur Folge hat; es ist ein ausgesprochenes Fraßgift mit gewisser Tiefenwirkung und es wirkt selektiv gegen die Larven von schädlichen Lepidoptera (Motten, Schmetterlinge); zusätzlich hat es eine ovizide Wirkung (Abtötung von Eigelegen der Schädlinge). Die Fraßstoppwirkung („antifeedant activity“) des Methoxyfenozid setzt bald nach der Aufnahme des Wirkstoffes durch die Schädlinge, noch vor deren Absterben, ein.[22]
Mit Leimringen an den Stämmen gegen das Hinaufklettern der Frühjahrsgeneration der Motten nach dem Schlüpfen, werden zum Teil großflächige Wirkungen erzielt.[23]
Bekämpfung mit Sexuallockstoffen
Im Handel gibt es Fallen mit Sexuallockstoffen (Pheromonen). Diese sind für Monitoring gut geeignet, Bekämpfungserfolge konnten mit den bisher erprobten Verfahren jedoch noch nicht erzielt werden.
Natürliche Feinde

Da sich die Rosskastanienminiermotte erst seit relativ kurzer Zeit in Mitteleuropa ausbreitet, gibt es keine Fressfeinde, die sich auf diese Tiere spezialisiert haben. Es wurden aber wiederholt Blau- und Kohlmeisen beobachtet, die zu bestimmten Zeiten in Kastanien in größeren Trupps Blatt für Blatt absuchen. Nach Beobachtungen an einer großen Rosskastanie im Ortsteil Kirchen der Gemeinde Efringen-Kirchen waren es beispielsweise am 25. August 2000, am 5. Juli 2001 und am 9. August 2003 jeweils ab circa 14 Uhr für rund 25 Minuten einige Tage hintereinander koordiniert durchziehende Schwärme von 30 bis 40 Blaumeisen. Die vielen Geräusche vom jeweiligen Aufpicken der Blattminen waren schräg darunter am Boden gut zu hören. Bei solchen Bäumen hält sich der Befall soweit in Grenzen, dass nur ein Teil der unteren Blätter vor dem Herbst abfällt. Blätter weiter oben weisen zwar die typischen Fraßspuren auf, sind aber ansonsten grün. Um zur Bekämpfung der Rosskastanienminiermotte gezielt Meisen anzulocken, wurden in verschiedenen deutschen Städten direkt an den Kastanienbäumen Nistkästen für Meisen angebracht, womit der Befall sichtlich verringert werden konnte.[24][25] Auch der BUND empfiehlt daher das Anbringen von Meisenkästen direkt an den befallenen Kastanienbäumen.[26]
Die Südliche Eichenschrecke wurde dabei beobachtet, dass sie die Minen aufbeißt und Larven und Puppen frisst.[27]
Eine zusätzliche Möglichkeit besteht in der Förderung weiterer natürlicher Feinde, zu denen neben Ameisen und Heuschrecken[11] auch Schlupfwespen zählen. Es sind etwa 30 parasitische Schlupfwespen-Arten bekannt, hauptsächlich Erzwespen aus der Familie der Eulophidae, die in den Raupen der Rosskastanienminiermotte parasitieren,[28] was letztlich zum Absterben der Larve bzw. der Puppe führt. In Schweden war die braconide Schlupfwespe Colastes braconius der Hauptparasit.[29] Zwei Schlupfwespen-Arten parasitieren die zwei Praepupa-Stadien und die Puppe.[30] Insgesamt gesehen ist die Parasitierungsrate mit 7 bis 10 % sehr gering.[13]
Schweizer Forscher haben in einem Projekt das Laub, das neben den Puppen der Rosskastaninienminiermotte auch die der Schlupfwespen enthält, in speziellen Laubcontainern gesammelt. Diese waren mit einer feinmaschigen Textilplane umgeben, so dass nur die kleineren Nützlinge entweichen konnten. Der Anteil der durch Schlupfwespen parasitierten Motten kann dadurch etwa verdoppelt werden.
Fehlende oder geringe Parasitierung kommt allgemein bei noch wenig adaptierten (also verschleppten), vor kurzem erst eingewanderten Adventivarten vor. Gerade die diskutierte Art ist ein gutes Beispiel für dieses Phänomen.[31]
Feuchtes Wetter vermindert den Befall.[32] Darüber hinaus wurde eine Larvenschädigung durch hohen Blattinnendruck beobachtet, der bei starker Durchfeuchtung des Bodens entsteht.
Laubsammlung
Um die Mottenlast für den Baum zu verringern, muss ganzjährig das Laub der Rosskastanie gesammelt und sofort vernichtet werden, damit die Puppen nicht überwintern können. Schon nach 2–3 Tagen verkriechen sich die Larven aus den heruntergefallenen Blättern in den Boden, wo sie überwintern.[33] Die über das ganze Jahr gebildeten Dauerstadien sind sehr widerstandsfähig; im Gegensatz zum Laub verrottet die Puppe nicht. Eine effektive Vernichtung der Puppen wird nur in kommerziellen Kompostieranlagen erreicht, da nur hier die notwendigen hohen Temperaturen von rund 60 °Celsius[34] erreicht werden. Eine einfache Kompostierung im Garten reicht also nicht aus. Alternativ ist eine Verbrennung des Laubs möglich, jedoch nicht überall grundsätzlich erlaubt. Verschiedene Umweltbehörden gestatten aber die Verbrennung von Kastanienlaub zur Mottenbekämpfung.[35]
Ebenfalls zulässig ist in einigen Gemeinden das Vergraben von Laub unter einer zwischen 10 und 50 cm starken Erdschicht oder das Zerkleinern mit einem Schredder oder Rasenmäher, womit man eine Abtötung der Puppen von über 80 % erreichen kann.[36]
Literatur
- Gerfried Deschka, Nenad Dimić: Cameraria ohridella n. sp. aus Mazedonien, Jugoslavien (Lepidoptera, Lithocolletidae). Acta Entomologica Jugoslavica, 22, 1986, S. 11-23.
- Jona Freise, Werner Heitland: Bionomics of the horse-chestnut leaf miner Cameraria ohridella Deschka & Dimić 1986, a pest on Aesculus hippocastanum in Europe. Senckenbergiana biologica, 84, Frankfurt/Main 2004, S. 61-80.
- Klaus Hellrigl: Neue Erkenntnisse und Untersuchungen über die Roßkastanien-Miniermotte Cameraria ohridella Deschka & Dimic, 1986 (Lepidoptera, Gracillariidae). In: Gredleriana. 1, 2001, S. 9–81 (zobodat.at [PDF]).
Weblinks
- Die Kastanien-Miniermotte - Die Schöne ist ein Biest (Memento vom 6. November 2009 im Internet Archive) – Informationen zum Aktionstag der SDW und Hintergrundinformationen der LWF zur Kastanienminiermotte
- „Rosskastanienminiermotte“ Flyer des Brandenburgischen Landesamtes (PDF, 344 KB), abgerufen am 28. Juli 2011, auf Seite 2 Aufführung der befallenen Arten und der Stärke der Schadwirkung
- Falter- und Raupenfotos auf www.lepiforum.de
- Woher kommt die Roßkastanienminiermotte wirklich?
- Ein Kleinschmetterling erobert Europa
- Unter dem Link www.cameraria.galk.de findet man alles zu den Themen Biologie und Verhalten, Pheromonfallen, Antagonisten, Grenzen und Möglichkeiten der Bekämpfung, Laubsammlung, Literatur sowie wichtige Filmsequenzen (DVD 2003, 43 min, deutsch) und die aktuellen Fotos 2002–2007.
- Cameraria ohridella bei Fauna Europaea
- Rosskastanienminiermotte (Cameraria ohridella Deschka et Dimic) (PDF; 46 kB)
- Über den Ursprung der Kastanienminiermotte /Ein Gespräch mit dem Direktor am Botanischen Garten und Botanischen Museum Berlin-Dahlem, Professor H. Walter Lack In: Onlinemagazin campus.leben der Freien Universität Berlin, 11. Juli 2011
- Video: Biologie und Bekämpfung der Rosskastanienminiermotte Cameraria ohridella. Institut für den Wissenschaftlichen Film (IWF) 2007, zur Verfügung gestellt von der Technischen Informationsbibliothek (TIB), doi:10.3203/IWF/C-13171.
Einzelnachweise
- Hubert Pschorn-Walcher: Zehn Jahre Rosskastanien-Miniermotte (Cameraria ohridella Deschka & Dimic; Lep., Gracillariidae) im Wienerwald. In: Linzer biologische Beiträge. 33. Jahrgang, Heft 2, Linz 2001 (zobodat.at [PDF]).
- Hubert Pschorn-Walcher: Freiland-Biologie der eingeschleppten Roßkastanien-Miniermotte Cameraria ohridella Deschka et Dimic, (Lep., Gracillariidae) im Wienerwald. In: Linzer biologische Beiträge. 24. Jahrgang, Linz 1994 (zobodat.at [PDF; 662 kB]).
- Christa Lethmayer: Über 10 Jahre Cameraria ohridella (Gracillariidae, Lepidoptera) - neue Nützlinge? In: Entomologica Austriaca. 8, 2003 (zobodat.at [PDF]).
- idw-online.de vom 21. Juni 2011: Hochinvasive Kastanienminiermotte lebte bereits 1879 am Balkan: Neue Fakten zur Herkunft.
- David C Lees et al.: Tracking origins of invasive herbivores through herbaria and archival DNA: the case of the horse-chestnut leaf miner. In: Frontiers in Ecology and the Environment, Online-Veröffentlichung 2011, doi:10.1890/100098
- Jona Freise, Werner Heitland: A brief note on sexual differences in pupae of the horse-chestnut leaf miner, Cameraria ohridella Deschka & Dimic (1986) (Lep., Gracillariidae), a new pest in Central Europe on Aesculus hippocastanum. Journal of Applied Entomology, 123: 191–193, 1999.
- Cameraria ohridella (horse-chestnut leaf miner) - Webseite von David Lees vom Natural History Museum.
- Tosio Kumata: A taxonomic revision of the Gracillaria group occuring in Japan (Lepidoptera: Incurvarioidea). Insecta matsumurana. Series entomology : Journal of the Faculty of Agriculture Hokkaidō University, New Series, 26: 1-186, 1963 PDF.
- Christine Tilbury, Hugh Evans: Exotic pest alert: Horse chestnut leaf miner, Cameraria ohridella Desch. & Dem. (Lepidoptera: Gracillariidae). UK Government PDF.
- Romain Valade, Marc Kenis, Antonio Hernandez–Lopez, Sylvie Augustin, Neus Mari Mena, Emmanuelle Magnoux, Rodolphe Rougerie, Ferenc Lakatos, Alain Roques, Carlos Lopez-Vaamonde: Mitochondrial and microsatellite DNA markers reveal a Balkan origin for the highly invasive horse–chestnut leaf miner Cameraria ohridella (Lepidoptera, Gracillariidae). Molecular Ecology, 18(16): 3458–3470, 2009. doi:10.1111/j.1365-294X.2009.04290.x
- Merkblatt zur Kastanienminiermotte vom Pflanzenschutzamt Berlin September 2012
- .
- N. A. Straw, M. Bellett-Travers: Impact and management of the Horse Chestnut leaf-miner (Cameraria ohridella). Arboricultural Journal: The International Journal of Urban Forestry, 28(1-2): 67–83, 2004 doi:10.1080/03071375.2004.9747402
- Stadtentwicklung Berlin: Flugverlauf der Kastanienminiermotte 2003. (PDF; 13 kB) Abgerufen am 4. Dezember 2011.
- A. Svatoš, B. Kalinová, M. Hoskovec, J. Kindl, I. Hrdý: Chemical communication in horse-chestnut leafminer: Cameraria ohridella Deschka & Dimić. Journal Plant Protection Science, 35(1): 10–13, 1999 Kurzfassung.
- Bogdan Syeryebryennikov: Ecology and control of horse chestnut leaf miner (Cameraria ohridella). 67 S., Shmalhausen Institute of Zoology, Kiev 2008 PDF.
- Elżbieta Weryszko-Chmielewska, Weronika Haratym: Changes in leaf tissue of common Horse Chestnut (Aesczlus hippocastanum) L.) colonised by the Horse-Chestnut leaf miner (Cameraria ochridella [sic] Deschka & Dimić. Acta agrobotanica, 64(4): 11-22, 2011 PDF.
- Tobias Rüther Angefressene Kastanien - Du kriegst die Motten In: FAZ 3. Oktober 2008, abgerufen am 2. März 2015.
- Peter Hummel: Die Kastanienminiermotte (Cameraria ohridella). Archiviert vom Original am 7. September 2012; abgerufen am 4. Dezember 2011.
- Bundesamt für Verbraucherschutz und Lebensmittelsicherheit: Verzeichnis zugelassener Pflanzenschutzmittel; Kultur: „Rosskastanien-Arten“; Schadorganismus: „Kastanienminiermotte“, abgerufen am 22. Juli 2012.
- Ishaaya, I.; Nauen, R.; Rami Horowitz, A. Eds: Insecticides Design Using Advanced Technologies. (Chap. 10: 3. Azadirachtin and Related Limonoids from the Meliaceae). Springer-Verlag, 2007. ISBN 978-3-540-46904-9.
- Krämer, W. et al.: Modern Crop Protection Compounds, Volume 3: Insecticides. 2nd Ed. (Chap. 28: Bisacylhydrazines: Novel Chemistry for Insect Control). Wiley-VCH, 2012, ISBN 978-3-527-32965-6.
- Umweltbericht Helmstedt 2005/2006 (Memento vom 24. September 2015 im Internet Archive).
- Nistkästen sollen Kastanien retten, Artikel der Frankfurter Neuen Presse vom 2. März 2017, zuletzt eingesehen am 6. November 2020.
- Meisen gegen Miniermotten, Artikel der Volksstimme vom 1. März 2016, zuletzt eingesehen am 13. Juni 2017.
- Archivierte Kopie (Memento vom 30. August 2018 im Internet Archive), Artikel der BUND Ortsgruppen Jüchen, zuletzt eingesehen am 17. Juni 2017.
- G. Grabenweger, P. Kehrli, B. Schlick-Steiner, F. Steiner, M. Stolz, S. Bacher: Predator complex of the horse chestnut leafminer Cameraria ohridella: identification and impact assessment. Journal of Applied Entomology, 129 (7): 353–362, 2005 doi:10.1111/j.1439-0418.2005.00973.x
- Gieselher Grabenweger, Patrick Kehrli, Irene Zweimüller, Sylvie Augustin, Nikolao Avtzis, Sven Bacher, Jona Freise, Sandrine Girardoz, Sylvain Guichard, Werner Heitland, Christa Lethmayer, Michaela Stolz, Rumen Tomov, Lubomir Volter, Marc Kenis: Temporal and spatial variations in the parasitoid complex of the horse chestnut leafminer during its invasion of Europe. Biologic Invasions, 12(8): 2797-2813, 2010 doi:10.1007/s10530-009-9685-z.
- Birgitta Rämert, Marc Kenis, Elisabeth Kärnestam, Monica Nyström, Linda-Marie Rännbäck: Host plant suitability, population dynamics and parasitoids of the horse chestnut leafminer Cameraria ohridella (Lepidoptera: Gracillariidae) in southern Sweden. Acta Agriculturae Scandinavica, Section B - Soil & Plant Science, 61(5): 480-486, 2011 doi:10.1080/09064710.2010.501341
- Lubomír Volter, Marc Kenis: Parasitoid complex and parasitism rates of the horse chestnut leafminer, Cameraria ohridella (Lepidoptera: Gracillariidae) in the Czech Republic, Slovakia and Slovenia. European Journal of Entomology, 103: 365–370, 2006 ISSN 1210-5759.
- Gerfried Deschka: Beitrag zur Populationsdynamik der Cameraria ohridella Deschka & Dimic (Gracillariidae, Lepidoptera, Chalcididae, Ichneumonidae, Hymenoptera), Linzer Biologische Beiträge, 27/1, Linz 1995.
- abgerufen am 23. Februar 2015.
- Das Kreuz mit dem Kastanienlaub Märkische Onlinezeitung, vom 7. November 2013, abgerufen am 23. Februar 2015.
- Umgang mit Herbstlaub (Memento vom 24. Februar 2015 im Internet Archive) Bürgerservice Fulda, abgerufen am 23. Februar 2015.
- Giselher Grabenweger: Auswirkungen der Fallaubentfernung auf Cameraria ohridella Deschka & Dimic (Lepidoptera, Gracillariidae) und ihre Parasitoiden, Institut für Pflanzenschutz, Universität für Bodenkultur Wien, 2001 (PDF (Memento vom 20. Oktober 2007 im Internet Archive); 24 kB)
- Merkblatt zur Laubentsorgung der Senatsverwaltung für Stadtentwicklung und Umwelt Berlin, abgerufen am 23. Februar 2015.
- Für Miniermotten wird’s ungemütlich. hello, Zeitschrift für die Mitarbeitenden von Syngenta in der Schweiz, 2. Ausgabe, September 2012, Seite 16 (PDF (Memento vom 3. März 2014 im Internet Archive); 2,1 MB)
- Harte Zeiten für Miniermotten Der Schweizerische Hauseigentümer, Nr. 6, 1. April 2013, Seite 25.