Mineralokortikoidrezeptor
Der Mineralokortikoidrezeptor (Aldosteron-Rezeptor, MR, NR3C2) ist ein nukleärer Rezeptor, der durch die Bindung der Steroidhormone Aldosteron oder Cortisol aktiviert wird und dann als Transkriptionsfaktor wirkt. Er ist in Niere und Dickdarm an der Regulation des Wasser-Elektrolyt-Haushalts beteiligt. Darüber hinaus hat er zahlreiche weitere Funktionen in verschiedenen anderen Geweben. Mutationen im NR3C2-Gen können eine Änderung in der Aktivität des Transkriptionsfaktors zur Folge haben; Loss-of-function-Mutationen sind dann die Ursache für Pseudohypoaldosteronismus Typ 1 und Gain-of-function-Mutationen führen zu angeborenem Bluthochdruck.[2]
| Mineralokortikoidrezeptor | ||
|---|---|---|
| ||
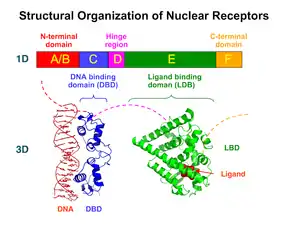
| Schematische Darstellung des strukturellen Aufbaus nukleärer Rezeptoren. | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 984 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Heterooligomer (unlegiert) | |
| Isoformen | 1, 2, 3, Delta | |
| Bezeichner | ||
| Gen-Name | NR3C2 | |
| Externe IDs | ||
| Vorkommen | ||
| Übergeordnetes Taxon | Wirbeltiere[1] | |
Struktur
Die Klonierung des Mineralokortikoidrezeptor-Gens wurde erstmals 1987 beschrieben.[3] Das MR-Gen liegt auf Chromosom 4, Region q31.1, und umfasst etwa 450 kB.[4] Innerhalb der Superfamilie der nukleären Rezeptoren gehört der Mineralokortikoidrezeptor zur Unterfamilie 3 (Estrogenrezeptor-artige), Gruppe C.[5]
Der Mineralokortikoidrezeptor ist aus drei funktionellen Domänen aufgebaut: Die N-terminale Domäne (NTD) interagiert zum einen Liganden-unabhängig mit Co-Faktoren und zum anderen abhängig von einem Liganden mit der Liganden-bindenden Domäne (LBD). Die Liganden-bindende Domäne weist eine hohe strukturelle Ähnlichkeit innerhalb der Steroidrezeptorfamilie auf.
Wirkmechanismus
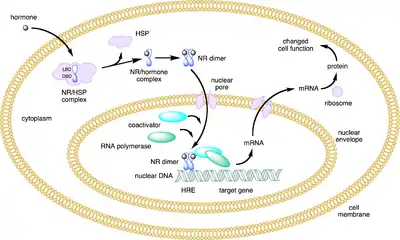
Der Wirkmechanismus des Mineralokortikoidrezeptors entspricht dem eines Transkriptionsfaktors. In Abwesenheit eines Liganden liegt der Rezeptor als Komplex mit Hitzeschockproteinen im Zytoplasma. Nach Bindung eines Liganden bildet MR Dimere und transloziert in den Zellkern. Dort bindet er an eine bestimmte DNA-Sequenz (AGAACANNNTGTTCT) in der Promotorregion von Zielgenen und reguliert so deren Transkription. Aldosteron und Cortisol binden mit vergleichbarer Affinität an MR, wobei Cortisol im Plasma in etwa 1000-fach höherer Konzentration vorliegt.[6] Die (relative) Selektivität von MR für Aldosteron wird durch verschiedene Mechanismen erreicht: Das co-exprimierte Enzym 11-beta-Hydroxsteroiddehydrogenase (11-βHSD2) wandelt Cortisol in die inaktive Form Cortison um und verhindert so die MR-Aktivierung. Darüber hinaus wird durch Interaktion von Rezeptoruntereinheiten miteinander sowie mit zahlreichen Co-Aktivatoren und -Repressoren die transkriptionelle Aktivität des Rezeptors beeinflusst.[6] Ein beschriebenes Zielgen des Mineralokortikoidrezeptors ist Serum-Glukokortikoid-regulierte Kinase 1 (Sgk1), eine Proteinkinase, die als Startpunkt für verschiedene zelluläre Signalkaskaden gilt.
Aldosteron vermittelt seine Wirkung auch MR-unabhängig über so genannte nicht-genomische Signalwege, die durch Hemmstoffe der Transkription und Antagonisten am Mineralokortikoidrezeptor nicht blockierbar sind.
Funktion
Der Mineralokortikoidrezeptor wird in zahlreichen Geweben exprimiert, unter anderem in der Niere und im Dickdarm, im Herzen und im Zentralnervensystem, wo er jeweils verschiedene Funktionen ausübt. Dabei wird vor allem die Funktion in Epithelzellen von der in Nicht-Epithelzellen unterschieden.
Epithel
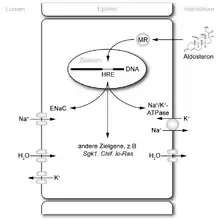
Der Mineralokortikoidrezeptor ist in Epithelzellen in Niere und Dickdarm an der Regulation des Wasser-Elektrolyt-Haushalts beteiligt. Die Aktivierung des Rezeptors führt zu vermehrter Expression von Ionenkanälen und -transportern wie dem Amilorid-sensitiven Natrium-Kanal (ENaC) und der basolateralen Natrium-Kalium-ATPase. Dadurch wird der Transport von Natrium über das Epithel erleichtert, was eine vermehrte Wasserrückresorption nach sich zieht. Gleichzeitig wird vermehrt Kalium ausgeschieden.
Herz-Kreislauf-System
Vermehrte Aktivierung des Mineralokortikoidrezeptors führt einerseits zu Bluthochdruck, wirkt sich aber auch unmittelbar auf das Herz aus, wo erhöhte Aldosteronspiegel eine pathologische Herzvergrößerung und Bindegewebseinlagerung verursachen können.[7] Die molekularen Mechanismen, die zu diesen Effekten führen, sind noch nicht abschließend geklärt. Es gibt Hinweise darauf, dass der Mineralokortikoidrezeptor in Makrophagen an der oben genannten Bindegewebsvermehrung pathogenetisch beteiligt ist.[8][9]
Zentralnervensystem
Mineralokortikoidrezeptoren liegen im Zentralnervensystem, unter anderem im Hypothalamus, in hoher Dichte vor. Es gibt Hinweise darauf, dass zentrale MR an der Steuerung des sympathischen Nervensystems und des Blutdrucks beteiligt sind.[10]
Pharmakologie
Antagonisten
Spironolacton ist ein kompetitiver Antagonist am Mineralokortikoidrezeptor und gehört zur Gruppe der kaliumsparenden Diuretika. Die Substanz ist seit langem im klinischen Einsatz und findet unter anderem bei der Therapie des Aszites Verwendung. Eine modernere Substanz ist Eplerenon, das aufgrund seiner höheren Spezifität für MR gegenüber anderen Steroidrezeptoren ein günstigeres Nebenwirkungsprofil aufweist. Anfang des 21. Jahrhunderts zeigten zwei große klinische Studien, RALES[11] und EPHESUS,[12] eine lebensverlängernde Wirkung von Aldosteronantagonisten bei chronischer Herzerkrankung und trugen so zu einer steigenden Bedeutung der Substanzen bei. 2011 konnten diese Ergebnisse für Patienten mit milder Herzinsuffizienz bestätigt werden.[13] Die klinisch angewandten Antagonisten Spironolacton und Eplerenon blockieren den Mineralokortikoidrezeptor im Herz-Kreislauf-System, aber auch in der Niere. Dadurch kann es zu Elektrolytstörungen und einer Verschlechterung der Nierenfunktion kommen. Es wird daher an der Entwicklung verschiedener alternativer Arzneistoffe gearbeitet, die auf einem veränderten Wirkprinzip oder einer veränderten Struktur basieren.[14] Die Substanz Finerenon zeigt aufgrund einer unterschiedlichen Pharmakokinetik und Verteilung eine höhere Aktivität im Herzen gegenüber der Niere und könnte so diese unerwünschten Wirkungen vermeiden, befindet sich jedoch noch in der klinischen Prüfung[15].
Agonisten
Klinische Verwendung findet das synthetische Mineralokortikoid Fludrocortison, das bei primärer Nebennierenrindeninsuffizienz im Rahmen adrenogenitaler Syndrome eingesetzt wird.
Literatur
- S Viengchareun, D Le Menuet, L Martinerie, M Munier, L Pascual-Le Tallec, M Lombès: The mineralocorticoid receptor: insights into its molecular and (patho)physiological biology. In: Nucl Recept Signal. 30, 5, 2007, S. e012, PMID 18174920
- L Pascual-Le Tallec, M Lombès: The mineralocorticoid receptor: a journey exploring its diversity and specificity of action. In: Mol Endocrinol. 19(9), 2005, S. 2211–2221, PMID 15802372
- JM Connell, E Davies: The new biology of aldosterone. In: J Endocrinol. 186(1), 2005, S. 1–20, PMID 16002531
- PJ Fuller, MJ Young: Mechanisms of mineralocorticoid action. In: Hypertension. 46(6), 2005, S. 1227–1235, PMID 16286565
Weblinks
- M.C. Zennaro: Pseudohypoaldosteronismus, renaler, Typ 1. In: orpha.net. Orphanet, Januar 2009, abgerufen am 19. Dezember 2010.
Einzelnachweise
- PROSITE documentation PDOC00031. Swiss Institute of Bioinformatics (SIB), abgerufen am 20. September 2011 (englisch).
- UniProt P08235
- Jeffrey L. Arriza, Cary Weinberger, Gail Cerelli, Tom M. Glaser, Barbara L. Handelin, David E. Housman, Ronald M. Evans: Cloning of Human Mineralocorticoid Receptor Complementary DNA: Structural and Functional Kinship with the Glucocorticoid Receptor. In: Science. 237(4812), 1987, S. 268–275
- Entrez Gene ID 4306
- A unified nomenclature system for the nuclear receptor superfamily. Nuclear Receptors Nomenclature Committee In: Cell. 97(2), 1999, S. 161–163, PMID 10219237 doi:10.1016/S0092-8674(00)80726-6
- L. Pascual-Le Tallec, M Lombès: The mineralocorticoid receptor: a journey exploring its diversity and specificity of action. In: Mol Endocrinol. 19(9),2005, S. 2211–2221, PMID 15802372
- CG Brilla, KT Weber: Mineralocorticoid excess, dietary sodium, and myocardial fibrosis. In: J Lab Clin Med. 120(6), 1992, S. 893–901, PMID 1453111
- AJ Rickard, J Morgan, G Tesch, JW Funder, PJ Fuller, MJ Young: Deletion of mineralocorticoid receptors from macrophages protects against deoxycorticosterone/salt-induced cardiac fibrosis and increased blood pressure. In: Hypertension. 54(3), 2009, S. 537–543. PMID 19635989
- MG Usher, SZ Duan, CY Ivaschenko, RA Frieler, S Berger, G Schütz, CN Lumeng, RM Mortensen: Myeloid mineralocorticoid receptor controls macrophage polarization and cardiovascular hypertrophy and remodeling in mice. In: J Clin Invest. 120(9), 2010, S. 3350–3364, PMID 20697155
- JC Geerling, AD Loewy: Aldosterone in the brain. In: Am J Physiol Renal Physiol. 297(3),2009, S. F559-576, PMID 19261742
- B Pitt, F Zannad, WJ Remme, R Cody, A Castaigne, A Perez, J Palensky, J Wittes: The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators. In: N Engl J Med. 2,341(10), 1999, S. 709–717, PMID 10471456
- B Pitt, W Remme, F Zannad, J Neaton, F Martinez, B Roniker, R Bittman, S Hurley, J Kleiman, M Gatlin: Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. In: N Engl J Med. 3, 348(14), 2003, S. 1309–1321, PMID 12668699
- F Zannad, JJ McMurray, H Krum, DJ van Veldhuisen, K Swedberg, H Shi, J Vincent, SJ Pocock, B Pitt: EMPHASIS-HF Study Group. Eplerenone in patients with systolic heart failure and mild symptoms. In: N Engl J Med. Jan 2011, 6, 364(1), S. 11–21, PMID 21073363
- A Lother, M Moser, C Bode, RD Feldman, L Hein: Mineralocorticoids in the Heart and Vasculature: New Insights for Old Hormones. In: Annu. Rev. Pharmacol. Toxicol. Feb 2015. 55:8.1–8.24. doi:10.1146/annurev-pharmtox-010814-124302.
- B Pitt B, L Kober, P Ponikowski, M Gheorghiade, G Filippatos, H Krum, C Nowack, P Kolkhof, SY Kim, F Zannad. Safety and tolerability of the novel non-steroidal mineralocorticoid receptor antagonist BAY 94-8862 in patients with chronic heart failure and mild or moderate chronic kidney disease: a randomized, double-blind trial. In: Eur Heart J. Aug 2013, 34(31), S. 2453–2463. PMID 23713082