Resorcinarene
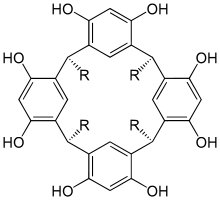
Resorcinarene (auch Calix[4]resorcinarene) sind makrocyclische Verbindungen, die sich vom Resorcin (1,3-Dihydroxybenzol) ableiten. Die Resorcineinheiten sind dabei jeweils über zwei Methylenbrücken miteinander verbunden, so dass ein cyclisches Oligomer aus vier aromatischen Resorcineinheiten entsteht. Sie sind eng verwandt mit Calixarenen, Pillararenen und Pyrogalloarenen und erinnern strukturell an Cyclodextrine. Mit Adolf von Baeyer und Donald J. Cram beschäftigten sich zwei Nobelpreisträger u. a. mit der Chemie von Resorcinarenen.
Synthese
Resorcinarene werden üblicherweise durch Kondensation eines Aldehyds mit Resorcin unter Brønstedt-Säurekatalyse in einem geeigneten Lösungsmittel oder Lösungsmittelgemisch unter Reflux dargestellt. Das Produkt kann durch Umkristallisation oder Chromatographie in reiner Form und oft in hoher Ausbeute erhalten werden.
In einer reversiblen Friedel-Crafts-artigen aromatischen Substitution greift der durch die Säure aktivierte Aldehyd das Resorcin in ortho- und para-Position an. Der dadurch entstehende Alkohol kann unter Säurekatalyse erneut ein Molekül Resorcin angreifen, wobei Wasser freigesetzt wird. In dieser Reaktion entsteht kein Kunststoff, wie in der eng verwandten Synthese von Phenoplasten, da die Reaktion reversibel ist (Retro-Friedel-Crafts), unter thermodynamischer Kontrolle geführt wird und da das entstehende Resorcinaren das thermodynamisch stabilere Produkt darstellt.[1][2]
Alternativ zu den oben genannten drastischen Reaktionsbedingungen können Resorcinarene auch unter lösungsmittelfreien Bedingungen[3][4] oder alternativ durch Lewissäure-katalysierte Protokolle ausgehend entweder von Resorcin/Aldehyden oder von Benzylalkoholen oder von Zimtsäureestern[5] dargestellt werden.
Struktur
Resorcinarene bestehen jeweils aus vier Resorcinmolekülen (1,3-Dihydroxybenzol), die über Methylenbrücken in 4- und 6-Position miteinander verbunden sind. Abhängig vom in der Synthese eingesetzten Aldehyd können die Methylenbrücken jeweils einen aliphatischen oder aromatischen Rest tragen, welcher zusätzliche Funktionalitäten aufweisen kann. Die Konfiguration der Stereozentren an den Methylenbrücken ist (meist) einheitlich.
Resorcinarene können in verschiedenen Konformationen vorliegen, von denen die Vasenförmige die am meisten beachtete ist, da sie mit ihrer konkaven Oberfläche als Halbkugel betrachtet werden kann. Diese auch schüssel- oder kronenförmig genannte Konformation weist einen durch Wasserstoffbrücken stabilisierten oberen Rand und einen unteren Rand auf. Der obere Rand ist mit insgesamt acht Hydroxygruppen dekoriert, welche kovalent verbrückt werden können, um die Vasenkonformation zu erzwingen bzw. zu stabilisieren.[6] Alternativ können die Hydroxygruppen auch zum Aufbau von Cavitanden oder Carceranden funktionalisiert werden, die sich durch ein relativ großes Innenvolumen auszeichnen, in welches Gastmoleküle eingelagert werden können.
Chemisch eng verwandte Makrocyclen sind die vom Phenol (Hydroxybenzol) abgeleiteten Calixarene und Pillararene, sowie die vom Pyrogallol (1,2,3-Trihydroxybenzol) abgeleiteten Pyrogalloarene.
Geschichte
Bereits Adolf von Baeyer ließ Aldehyde mit Resorcin reagieren, konnte das entstehende harzige Produkt allerdings mit Hilfe der damaligen Analytik nicht charakterisieren.[7][8] Seitdem isolierten andere Forscher bei ähnlichen Reaktionen kristalline Produkte, konnten diese aber nur schlecht charakterisieren. Niederl und Vogel schlugen ein halbes Jahrhundert nach Baeyer die tetramere cylische Struktur für diese Produkte vor,[9] was erst knapp 50 Jahre später endgültig bestätigt wurde (siehe unten). Aufbauend auf den Vorarbeiten von Erdtman und Kollegen[10] synthetisierte Högberg[1][11] Resorcinarene und wies deren Struktur NMR-spektroskopisch nach. Letzte Zweifel an der tetrameren Struktur der Resorcinarene konnten später durch Röntgenstrukturanalyse ausgeräumt werden.[12] Als einer der Ersten erkannten u. a. Aoyama und Kollegen das Potenzial der Resorcinarene für Wirt-Gast-Systeme.[13] Mittlerweile ist bekannt, dass sich die unmodifizierten konkaven Resorcinarene unter bestimmten Bedingungen zu hexameren Kapseln zusammenlagern[14][15], in deren Innenraum wieder unter bestimmten Bedingungen auch katalytische Reaktionen möglich sind.[16] Populär sind Resorcinarene jedoch vor allem als Grundlage synthetischer Rezeptoren (siehe unten).
Verwendung
In der supramolekularen Chemie werden Resorcinarene als Grundlage zum Aufbau von molekularen Containern (synthetischen Rezeptoren) wie Cavitanden[17] oder Carceranden[18][19], die Gastmoleküle in ihrem Innenraum einlagern können, verwendet. Sie werden aber auch als Füllmaterial für Chromatographiesäulen verwendet.
Einzelnachweise
- A. G. Sverker Högberg: Cyclooligomeric phenol-aldehyde condensation products. 2. Stereoselective synthesis and DNMR study of two 1,8,15,22-tetraphenyl[14]metacyclophan-3,5,10,12,17,19,24,26-octols. In: Journal of the American Chemical Society. Band 102, Nr. 19, 1980, S. 6046–6050, doi:10.1021/ja00539a012.
- Luigi Abis, Enrico Dalcanale, Annick Du Vosel, Silvia Spera: Structurally new macrocycles from the resorcinol-aldehyde condensation. Configurational and conformational analyses by means of dynamic NMR, NOE, and T1 experiments. In: Journal of Organic Chemistry. Band 53, Nr. 23, 1988, S. 5475–5479, doi:10.1021/jo00258a015.
- Brett A. Roberts, Gareth W. V. Cave, Colin L. Raston, Janet L. Scott: Solvent-free synthesis of calix[4]resorcinarenes. In: Green Chemistry. Band 3, Nr. 6, 2001, S. 280–284, doi:10.1039/B104430N.
- Jochen Antesberger, Gareth W. V. Cave, Matthew C. Ferrarelli, Michael W. Heaven, Colin L. Raston, Jerry L. Atwood: Solvent-free, direct synthesis of supramolecular nano-capsules. In: Chemical Communications. Nr. 7, 2005, S. 892–894, doi:10.1039/B412251H.
- Bruno Botta, Maria C. Di Giovanni, Giuliano Delle Monache, Maria C. de Rosa, Eszter Gacs-Baitz, Maurizio Botta, Federico Corelli, Andrea Tafi, Antonello Santini: A Novel Route to Calix[4]arenes. 2. Solution- and Solid-State Structural Analyses and Molecular Modeling Studies. In: Journal of Organic Chemistry. Band 59, Nr. 6, 1994, S. 1532–1541, doi:10.1021/jo00085a047.
- Donald J. Cram: Cavitands: Organic Hosts With Enforced Cavities. In: Science. Band 219, Nr. 4589, 1983, S. 1177–1183, doi:10.1126/science.219.4589.1177.
- Adolf Baeyer,: Ueber die Verbindungen der Aldehyde mit den Phenolen. In: Berichte der deutschen chemischen Gesellschaft. Band 5, Nr. 1, 1872, S. 280–282, doi:10.1002/cber.18720050186.
- Adolf Baeyer,: Ueber die Verbindungen der Aldehyde mit den Phenolen und aromatischen Kohlenwasserstoffen. In: Berichte der deutschen chemischen Gesellschaft. Band 5, Nr. 2, 1872, S. 1094–1100, doi:10.1002/cber.187200502157.
- Joseph B. Niederl, Heinz J. Vogel: Aldehyde—Resorcinol Condensations. In: Journal of the American Chemical Society. Band 62, Nr. 9, 1940, S. 2512–2514, doi:10.1021/ja01866a067.
- H. Erdtman, F. Haglid, R. Ryhage: Macrocyclic Condensation Products of Veratrole and Resorcinol. In: Acta Chemica Scandinavica. Band 18, Nr. 5, 1964, S. 1249–1254, doi:10.3891/acta.chem.scand.18-1249.
- A. G. Sverker Högberg: Two stereoisomeric macrocyclic resorcinol-acetaldehyde condensation products. In: Journal of Organic Chemistry. Band 45, Nr. 22, 1980, S. 4498–4500, doi:10.1021/jo01310a046.
- Donald J. Cram, Kent D. Stewart, Israel Goldberg, Kenneth N. Trueblood: Complementary solutes enter nonpolar preorganized cavities in lipophilic products. In: Journal of the American Chemical Society. Band 107, Nr. 8, 1985, S. 2574–2575, doi:10.1021/ja00294a075.
- Yasuhiro Aoyama, Yasutaka Tanaka, Hiroo Toi, Hisanobu Ogoshi: Polar host-guest interaction. Binding of nonionic polar compounds with a resorcinol-aldehyde cyclooligomer as a lipophilic polar host. In: Journal of the American Chemical Society. Band 110, Nr. 2, 1988, doi:10.1021/ja00210a073.
- Alexander Shivanyuk,Julius Rebek Jr.: Reversible encapsulation by self-assembling resorcinarene subunits. In: Proceedings of the National Academy of Sciences of the USA. Band 98, Nr. 14, 2001, S. 7662–7665, doi:10.1073/pnas.141226898.
- Jerry L. Atwood, Leonard J. Barbour, Agoston Jerga: Organization of the interior of molecular capsules by hydrogen bonding. In: Proceedings of the National Academy of Sciences of the USA. Band 99, Nr. 8, 2002, S. 4837–4841, doi:10.1073/pnas.082659799.
- Alessandra Cavarzan, Alessandro Scarso, Paolo Sgarbossa, Giorgio Strukul, Joost N. Reek, H.: Supramolecular Control on Chemo- and Regioselectivity via Encapsulation of (NHC)-Au Catalyst within a Hexameric Self-Assembled Host. In: Journal of the American Chemical Society. Band 133, Nr. 9, 2011, S. 2848–2851, doi:10.1021/ja111106x.
- Julius Rebek Jr.: Molecular Behavior in Small Spaces. In: Accounts of Chemical Research. Band 42, Nr. 10, 2009, S. 1660–1668, doi:10.1021/ar9001203.
- Donald J. Cram: Molecular container compounds. In: Nature. Band 356, Nr. 6364, 1992, S. 29–36, doi:10.1038/356029a0.
- Donald J. Cram: The Design of Molecular Hosts, Guests, and Their Complexes. In: Nature. Band 240, Nr. 4853, 1988, S. 760–767, doi:10.1126/science.3283937.