Calixarene
Calixarene (Calix = lat. für „Kelch“; mit dem dt. Wort verwandt) sind eine Klasse organischer makrocyclischer Verbindungen. Calixarene bestehen aus Phenoleinheiten, die jeweils in ortho-Stellung zur OH-Gruppe mit Methylenbrücken verbunden sind. Die Zahl der enthaltenen Monomere wird als [n] in Calix[n]arene angegeben. Am häufigsten findet man Tetramere aus 4 Phenoleinheiten; diese heißen daher Calix[4]arene. Aber auch Pentamere (Calix[5]arene), Hexamere (Calix[6]arene) und Oktamere (Calix[8]arene) sind durch Variation der Reaktionsbedingungen (Temperatur, Lösungsmittel usw.) in sogenannten Eintopfreaktionen verhältnismäßig bequem zugänglich. Andere Anzahlen als 4, 5, 6, oder 8 Phenoleinheiten sind zwar ebenfalls möglich, aber bisher bedeutungslos geblieben, da ihre gezielte Synthese zu aufwendig ist.
Synthese
Calixarene lassen sich säure- und basenkatalysiert aus Phenolen und Formaldehyd synthetisieren.[1] Man benutzt vorzugsweise in para-Stellung substituierte Phenole, um einer Polymerisation vorzubeugen. Neben den „klassischen“ Phenolcalixarenen gibt es auch Calixarene, die aus Resorcin (sog. Resorcinarene) oder Pyrogallol mit längerkettigen Aldehyden hergestellt werden. Die ablaufende Reaktion ist eine elektrophile aromatische Substitution mit anschließender Wasserabspaltung. Spezielle Calixarene kann man auch durch Fragmentkondensation oder Aufbau eines linearen Vorläufermoleküls mit anschließender Ringschlussreaktion erhalten.
Struktur
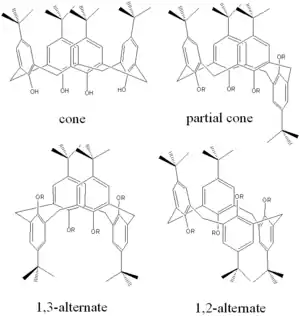
Bei den Calixarenen sind infolge der gehinderten Rotation um die Methylenbrücken unterschiedliche geometrische Molekülstrukturen möglich. Die vasenähnliche Konformation (Cone-Struktur, Punktgruppe C4v) lässt sich durch sperrige Substituenten stabilisieren. Neben dieser Struktur existieren drei weitere Konformationen, partial cone (CS), 1,2-alternate (C2h) und 1,3-alternate (D2d). Bei Synthesen mit Calixarenen erfolgt mitunter Konformationsänderung, diese kann in bestimmten Fällen durch die Wahl der Reaktionsbedingungen unterdrückt oder aber — falls erwünscht — auch gezielt herbeigeführt werden.
Geschichte
1902 wurde von Leo Baekeland erstmals ein Harz aus Phenol und Formaldehyd hergestellt, das Bakelit. Durch die drei Angriffsmöglichkeiten am Phenol in ortho- und para-Position entstand ein dreidimensionales Netzwerk. Erst im Jahre 1942 versuchten Alois Zinke und Erich Ziegler eine gesteuerte Synthese des Polymers mit p-tert-Butylphenol und Formaldehyd. Sie erhielten eine kristalline Substanz, konnten jedoch aufgrund der damaligen Möglichkeiten nur eine Schmelzpunkterniedrigung zur Molekülmassenbestimmung durchführen. Erst John Cornforth erhielt mit Hilfe von Dorothy Mary Hodgkin eine Kristallstrukturanalyse dieser Substanzen.
1975 wurde der Name „Calixaren“ für diese Substanzklassen von David Gutsche empfohlen, er setzte sich allmählich auch für verwandte Körper (z. B. Resorcinarene) durch. Gutsche erkannte überdies die Instabilität der cone-Konformation bei unsubstituierten Calixarenen und Donald J. Cram schaffte eine Stabilisierung unsubstituierter Calixarene in Cone-Konformation durch Kohlensäureester.
Anwendungen
Die meisten Synthesen, welche man aus der Chemie der Phenole kennt, sind prinzipiell auch auf Calixarene anwendbar, allerdings muss man die besondere Molekülgeometrie berücksichtigen, welche mitunter bestimmte Reagenzien am Angriff behindert. An der phenolischen OH-Gruppe kann man Calixarene verestern und verethern; an dem zu ihr para-ständigen C-Atom sind verschiedene Substitutionen möglich. Calixarene dienen gleichsam als molekulares Skelett für verschiedenartige Chelat-Komplexbildner und Sensoren für Natriumionen. Durch Funktionalisierungen lässt sich die Selektivität für Cadmium, Blei, Lanthanoide und Actinoide erhöhen. Zudem können Calixarene in stationären Phasen bei der HPLC oder der Elektronenstrahllithografie eingesetzt werden. Calixarene katalysieren daneben verschiedene Reaktionen; so wird z. B. die Reaktionsgeschwindigkeit bei der Menschutkinreaktion zwischen Chinuclidin und 1-Butylbromid um den Faktor 1600 erhöht.[2]
Auch für pharmazeutische Anwendungen sind Calixarene als potenzielle Arzneistoffe, Diagnostika oder Arzneistoffträger von Interesse. Mit Hilfe von zyklischen Peptidgruppen modifizierte Calixarene besitzen Antikörper-ähnliche Eigenschaften bei der Bindung von Proteinen und können als Antikörpermimetika eingesetzt werden.[3]
Literatur
- Gutsche, C. David (1989). Calixarenes. Cambridge: Royal Society of Chemistry.
- Byron W. Purse, Arnaud Gissot, Julius Rebek: A Deep Cavitand Provides a Structured Environment for the Menschutkin Reaction. In: Journal of the American Chemical Society. Band 127, Nr. 32, 2005, S. 11222–11223, doi:10.1021/ja052877+.
- Yoshitomo Hamuro, Mercedes Crego Calama, Hyung Soon Park, Andrew D. Hamilton: A Calixarene with Four Peptide Loops: An Antibody Mimic for Recognition of Protein Surfaces. In: Angew. Chem. Int. Ed. Engl. Band 36, Nr. 23, 1997, doi:10.1002/anie.199726801.