Regorafenib
Regorafenib ist ein Tyrosinkinaseinhibitor, der derzeit für den Einsatz bei verschiedenen Tumortypen untersucht wird. Für die Behandlung des kolorektalen Karzinoms besteht in den USA eine Zulassung seit 2012,[2] in der EU seit 2013.[3] Darüber hinaus ist Regorafenib zur Zweitlinienbehandlung des Leberzellkarzinoms zugelassen.[4] Aktuell (2/2015) wird eine Phase-II-Studie zur Behandlung bei chorioidealen Neovaskularisationen der Netzhaut (feuchte Makuladegeneration) in Deutschland durchgeführt. Ziel ist die Zulassung zur Anwendung als Augentropfen.[5]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
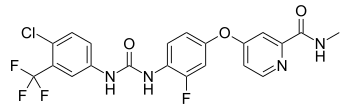 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Regorafenib | |||||||||||||||||||||
| Andere Namen |
4-[4-({[4-Chlor-3-(trifluormethyl)phenyl]carbamoyl}amino)-3-fluorphenoxy]-N-methylpyridin-2-carboxamid-Hydrat | |||||||||||||||||||||
| Summenformel | C21H15ClF4N4O3 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer bis leicht blasser rötlich gelber Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
L01XE21 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 482,82 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt |
208 °C[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Anwendungsgebiete
Regorafenib wird derzeit für die Behandlung eines metastasierten kolorektalen Karzinoms bei Erwachsenen verwendet, wenn die ersten Behandlungsvarianten nicht den gewünschten Effekt erzielt haben. Außerdem wird es für die Behandlung des gastrointestinalen Stromatumors (GIST) verwendet.[6] Im August 2017 erhielt Bayer auch die europäische Zulassung zur Zweitlinienbehandlung des Leberzellkarzinoms.[4]
Wirkung
Regorafenib wirkt über die Hemmung verschiedener Kinasen (VEGFR, TIE2, KIT, RET, RAF-1, BRAF, BRAFV600E, PDGFR, FGFR) antitumoral und antiangiogenetisch. Die neue Nutzenbewertung des Arzneimittels zeigte kürzlich einen durchschnittlichen Überlebensvorteil von 1,5 Monaten.[7]
Nebenwirkungen
Häufige unerwünschte Nebenwirkungen sind Schwäche, Erschöpfung, Appetitverlust, verminderte Nahrungsaufnahme, Hand-Fuß-Syndrom, Durchfall, Gewichtsverlust, Infektionen, Bluthochdruck und Stimmstörungen.[8]
Zudem ist Regorafenib lebertoxisch. Durch den Abbau über CYP3A4 und UGT1A9 hat es auch ein Potential für diverse Arzneimittelwechselwirkungen.
Marktrücknahme
Am 17. März 2016 hat der Gemeinsame Bundesausschuss beschlossen, Regorafenib (Stivarga®) keinen Zusatznutzen bei der Behandlung von Erwachsenen mit metastasiertem Kolorektalkarzinom (KRK) gegenüber bestmöglicher supportiver Behandlung zuzusprechen. Der Pharmahersteller Bayer nahm daraufhin das Medikament vom deutschen Markt, weil er keine Möglichkeit sah, in den Verhandlungen mit den Krankenkassen einen wirtschaftlich akzeptablen Preis zu erzielen.
Quellen
- Eintrag zu Regorafenib bei TCI Europe, abgerufen am 11. Oktober 2018.
- FY 2012 Innovative Drug Approvals, FDA Bericht, Seite 14, abgerufen am 8. August 2017.
- EMA - Regorafenib - Authorisation details.
- Bayer erhält EU-Zulassung für Stivarga® zur Zweitlinienbehandlung des Leberzellkarzinoms, Meldung auf oncotrends.de, abgerufen am 8. August 2017
- Research - Das Bayer Forschungsmagazin.
- Zusammenfassung des EPAR für die Öffentlichkeit, EPAR der EMA, abgerufen am 8. August 2017.
- Regorafenib - Nutzenbewertung.
- EMA: Stivarga Regorafenib.

