Pyruvatkinase M2
Pyruvatkinase M2 (PKM2, auch: M2-PK oder Tumor-M2-PK) ist ein Enzym im Menschen, das nur in fötalem und in Tumorgewebe vorkommt, und daher als Tumormarker dient. Es ist eine Isoform der Pyruvatkinase mit der Bezeichnung M2. Die Pyruvatkinase M2 ist ein Schlüsselenzym im Tumorstoffwechsel und kann zur Therapie und Verlaufskontrolle verschiedener Tumorerkrankungen eingesetzt werden. Die Pyruvatkinase M2 ist kein organspezifischer Tumormarker, wie beispielsweise PSA, vielmehr reflektiert der Gehalt an Pyruvatkinase M2 im Stuhl oder im EDTA-Blutplasma als Biomarker den spezifischen Stoffwechselzustand der Tumoren.
| Pyruvatkinase Isoform M2 | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 530 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer, Homotetramer | |
| Kofaktor | Magnesium, Kalium | |
| Isoformen | L, R, M1, M2 | |
| Bezeichner | ||
| Gen-Name | PKM2 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 2.7.1.40, Kinase | |
| Reaktionsart | Phosphorylierung | |
| Substrat | ADP + Phosphoenolpyruvat | |
| Produkte | ATP + Pyruvat | |
| Vorkommen | ||
| Homologie-Familie | Pyruvatkinase | |
| Übergeordnetes Taxon | Euteleostomi | |
Funktion der Pyruvatkinase M2 im Tumor-Stoffwechsel
Die Pyruvatkinase katalysiert den letzten Schritt innerhalb der Glycolyse, die Dephosphorylierung von Phosphoenolpyruvat zu Pyruvat und ist für die Netto-Energiegewinnung in diesem Stoffwechselweg verantwortlich.
In Abhängigkeit von den unterschiedlichen metabolischen Aufgaben der verschiedenen Gewebe werden unterschiedliche Isoenzyme der Pyruvatkinase exprimiert.
Die M2-PK ist das charakteristische Pyruvatkinase-Isoenzym aller sich teilenden Zellen. Dazu gehören physiologische Zellen, wie z. B. Fibroblasten, embryonale Zellen oder adulte Stammzellen, aber auch Tumorzellen.
Während der Tumorentstehung kommt es zu einem Wechsel im Isoenzymmuster der Zellen, wobei das jeweilige Gewebe-spezifische Isoenzym, wie zum Beispiel die L-PK in der Leber oder die M1-PK im Gehirn verschwindet und das Isoenzym Typ M2 vermehrt gebildet wird.
Bedeutung der tetrameren und dimeren Form der Pyruvatkinase M2 im Tumor-Stoffwechsel
Die M2-PK kann in proliferierenden Zellen in zwei unterschiedlichen Zustandformen auftreten:
- in einer tetrameren Form, die aus vier Untereinheiten zusammengesetzt ist und
- in einer dimeren Form, die aus zwei Untereinheiten besteht.
Die tetramere Form der M2-PK hat eine hohe Affinität zum Substrat Phosphoenolpyruvat und ist unter physiologischen Bedingungen hochaktiv. Weiterhin ist die tetramere Form mit anderen Enzymen im Cytosol im sogenannten Glycolyse-Enzym-Komplex assoziiert, der durch die räumliche Nähe der Enzyme zueinander eine hocheffektive Umsetzung von Glucose zu Pyruvat und Lactat ermöglicht.
Liegt die M2-PK überwiegend in der hochaktiven tetrameren Form vor, wie dies in den meisten normal proliferierenden Zellen der Fall ist, wird die Glucose überwiegend unter Energieproduktion zu Pyruvat abgebaut.
Die dimere Form der M2-PK hat eine geringe Affinität zum Substrat und ist unter physiologischen Bedingungen nahezu inaktiv. Die dimere Form ist nicht im Glycolyse-Enzym-Komplex assoziiert.
Liegt die M2-PK überwiegend in der wenig aktiven dimeren Form vor, wie dies in Tumorzellen der Fall ist, kommt es oberhalb der Pyruvatkinase Reaktion zu einem Rückstau aller Glycolyse-Zwischenprodukte. Diese stehen den Zellen als Ausgangsstoffe für aus der Glycolyse abzweigende Syntheseprozesse zur Verfügung. Zu diesen Synthesewegen gehören die Nukleinsäure-, Phospholipid- und Aminosäure-Synthese.
Nukleinsäuren, Phospholipide und Aminosäuren sind wichtige Zellbausteine, die hochteilungsaktive Zellen, wie dies Tumorzellen sind, dringend benötigen.
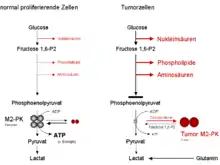
Aufgrund der Schlüsselstellung der Pyruvatkinase als letztes Enzym innerhalb der Glycolyse entscheidet somit das Tetramer:Dimer-Verhältnis der M2-PK, ob die Glucose-Kohlenstoffatome unter Energiegewinnung zu Pyruvat und Lactat abgebaut werden (tetramere Form) oder in Synthesewege eingeschleust werden.
Da in Tumorzellen generell die dimere Form der M2-PK überwiegt, wurde die dimere Form der M2-PK als Tumor-M2-PK bezeichnet.
Die Dimerisierung der M2-PK wird in Tumorzellen durch direkte Interaktion der M2-PK mit verschiedenen Oncoproteinen induziert.
Allerdings ist das Verhältnis von Tetramer zu Dimer der M2-PK in Tumorzellen kein statischer Zustand. Sauerstoffmangel oder hochangestaute Stoffwechsel-Zwischenprodukte, wie zum Beispiel das Glycolyse-Zwischenprodukt Fructose-1,6-P2 oder die Aminosäure Serin, induzieren die Reassoziation der dimeren Form der M2-PK zur tetrameren Form. In der Folge wird durch die Reaktivierung der M2-PK die Glucose solange unter Energieproduktion zu Pyruvat und Lactat abgebaut, bis die Fructose-1,6-P2-Spiegel unter einen bestimmten Grenzwert fallen und die M2-PK wieder in die dimere Form dissoziiert. Der Oscillationscyclus startet erneut, wenn die Fructose-1,6-P2-Spiegel wieder über ihren Signal-Spiegel steigen und die Tetramerisierung der M2-PK induzieren.
Liegt die M2-PK überwiegend in der wenig aktiven dimeren Form vor, kann die Energie über den Abbau der Aminosäure Glutamin zu Aspartat, Pyruvat und Lactat (= Glutaminolyse) bereitgestellt werden.
Die in Tumorzellen beobachtete erhöhte Bildung von Lactat in Gegenwart von Sauerstoff wird als Warburg-Effekt bezeichnet.
Labortest
Pyruvatkinase-M2-Screening zur Früherkennung von kolorektalen Tumoren und Polypen
Der M2-PK-Test ist eine Stuhluntersuchung zur Darmkrebsfrüherkennung. Die Bestimmung im Stuhl erfolgt durch die ELISA-Technologie im Labor oder durch einen Lateral-Flow-Test in der Arztpraxis. Positive Ergebnisse sollten anhand einer Darmspiegelung abgeklärt werden. Der Test ist in Deutschland seit 2007 als Individuelle Gesundheitsleistung (IGeL) erhältlich. Der IGeL-Monitor des MDS (Medizinischer Dienst des Spitzenverbandes Bund der Krankenkassen) hat die wissenschaftliche Literatur zum M2-PK-Test analysiert und bewertet diese Selbstzahlerleistung mit „unklar“. Es fänden sich keine Belege, dass der M2-PK-Test zur Früherkennung von Darmkrebs mehr Tumore und fortgeschrittene Adenome erkennt und mehr Menschen korrekt als gesund einstuft als der Blutstuhltest. Somit sieht der IGeL-Monitor keine Hinweise auf einen Nutzen des M2-PK-Tests, wenn er ergänzend oder alternativ zum Blutstuhltest eingesetzt wird, aber auch keine Hinweise auf einen Schaden.[1] Auch die ärztliche Handlungsempfehlung (Leitlinie „Kolorektales Karzinom“) aus dem Jahr 2017 empfiehlt den M2-PK-Test nicht für die Darmkrebs-Vorsorge bzw. -Früherkennung.[2]
Die Wahrscheinlichkeit, durch einen M2-PK-Test einen vorhandenen Darmkrebs zu entdecken (Sensitivität) liegt beim ELISA bei 80,3 %[3] (60–100 % in Abhängigkeit von der Tumorgröße[4]), die Spezifität (korrekter Ausschluss eines Tumors) bei 93 %[3][4]. Bemängelt wird jedoch: Von 10 Erkrankten werden 9 durch den Test erkannt. Allerdings kommt es auch bei 247 von 990 gesunden Testpersonen (25%) zu einem falsch positiven Testergebnis. Nur 9 von 256 positiv Getesteten (3,5%) sind demnach tatsächlich erkrankt.[5] (Bei einer Gruppe von 1000 Testpersonen.) Wegen der schlechten Spezifität (82 %) ist der Nachweis von M2-PK im Stuhl für Screeninguntersuchungen nicht geeignet.[6] Die in vereinzelten Studien gezeigten niedrigen Spezifitätswerte lassen sich, wie sich inzwischen gezeigt hat, im Wesentlichen darauf zurückführen, dass das Studiendesign mit schweren methodischen Mängeln behaftet war. Zum Beispiel wurden bereits erkrankte Personen mit in die betreffenden Studien aufgenommen. Um eine Screeningmethode zu evaluieren, ist es jedoch unerlässlich, ausschließlich symptomfreie Personen in die Studie aufzunehmen, um eine Verfälschung des Testergebnisses durch verschiedenste Vorerkrankungen der Probanden zu vermeiden. Im August 2012 erschien eine Metaanalyse, in welcher 17 Studien mit insgesamt über 11.000 asymptomatischen Probanden, mehr als 700 an Darmkrebs erkrankten- und über 500 Personen mit Polypen umfassend ausgewertet wurden. Die Überlegenheit des Biomarkers sehen die Autoren in der Tatsache begründet, dass er unmittelbar Rückschlüsse auf den Tumorstoffwechsel ermöglicht und sehen den Vorteil des M2-PK Tests insbesondere darin, dass der Test sowohl blutende als auch nicht blutende Tumoren und Adenome erkennt. Zusammenfassend kommen die Autoren zu dem Schluss, dass der M2-PK Test sowohl als ELISA als auch als Lateral-Flow Schnelltest einen kosteneffektiven und einfach durchzuführenden Routinetest darstellt und enden die Analyse mit dem Fazit, dass der Test für das Screening auf kolorektale Karzinome uneingeschränkt zu empfehlen ist.[3]
Beim Lateral-Flow-Test liegt die Sensitivität, je nach Studie, isoliert für das Kolonkarzinome bei 85 % (65–96 %) und 56 % (41–74 %) für Rektumkarzinome,[7] zusammen für das kolorektale Karzinom bei 81,1 %[8] bei einer Spezifität von 79 % (76–81 %)[7] bis 86,7 %[8]. Damit ist der M2-PK-Test genauer als die derzeit von den gesetzlichen Krankenkassen Deutschlands erstatteten Tests auf Blut im Stuhl (Guajak-Test), die Darmkrebs nur zu ca. 20–40 % entdecken (Sensitivität) bei einer Spezifität von 92,2 %[9][10][8]. Eine im August 2012 erschienene Metaanalyse mit 11.000 asymptomatischen Probanden zeigte eine Sensitivität für kolorektale Karzinome von 80,3 % und eine Spezifität von 95,2 %.[3]
Pyruvatkinase-M2-Messungen zur Therapie- und Verlaufskontrolle bei verschiedenen Tumorerkrankungen
Studien internationaler Arbeitsgruppen haben gezeigt, dass der Gehalt an M2-PK im EDTA-Plasma von Patienten mit Nieren-, Lungen-, Brust-, Zervikaltumoren, Tumoren des Gastrointestinaltraktes (Oesophagus,[11] Magen, Pankreas,[12] Kolon und Rektum[3]) sowie beim malignen Melanom mit dem Stadium der Tumoren korreliert.
Ein wichtiges Anwendungsgebiet des Nachweises der M2-PK im EDTA-Plasma sind daher Verlaufskontrollen unter der Therapie, die es ermöglichen, den Erfolg oder Misserfolg einer Therapie frühzeitig zu erkennen. Fallen die M2-PK-Werte im EDTA-Plasma des Tumor-Patienten unter der Therapie ab und bleiben sie dauerhaft niedrig, deutet dies auf einen guten Erfolg der Therapie hin. Steigen die M2-PK-Werte während oder nach der Therapie an, ist dies ein Hinweis darauf, dass sich ein Rezidiv und/oder Metastasen gebildet haben.[13] Erhöhte M2-PK-Werte können auch bei entzündlichen Erkrankungen auftreten und müssen differentialdiagnostisch ausgeschlossen werden.
Einzelnachweise
- IGeL-Monitor, M2-PK-Test zur Früherkennung von Darmkrebs. Abgerufen am 8. Oktober 2018.
- Leitlinie (Handlungsempfehlung für Ärzte) „Kolorektales Karzinom“ vom 30. November 2017
- C. Tonus, M. Sellinger u. a.: Faecal pyruvate kinase isoenzyme type M2 for colorectal cancer screening: A meta-analysis. (Memento des Originals vom 9. Oktober 2014 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (PDF; 937 kB) In: World journal of gastroenterology : WJG. Band 18, Nummer 30, August 2012, S. 4004–4011, ISSN 1007-9327. doi:10.3748/wjg.v18.i30.4004. PMID 22912551. PMC 3419997 (freier Volltext).
- C. Tonus, G. Neupert, M. Sellinger: Colorectal cancer screening by non-invasive metabolic biomarker fecal tumor M2-PK. (PDF; 789 kB) In: World journal of gastroenterology : WJG. Band 12, Nummer 43, November 2006, S. 7007–7011, ISSN 1007-9327.PMID 17109496.
- arznei-telegramm 6/2007: ENZYMTEST "M2-PK" ÜBERLEGENER SCREENINGMARKER FÜR DARMKREBS?
- U. Haug, S. Hundt, H. Brenner: Sensitivity and specificity of faecal tumour M2 pyruvate kinase for detection of colorectal adenomas in a large screening study. In: Br J Cancer. 99(1), 2008 Jul 8, S. 133–135. Epub 2008 Jun 10 PMID 18542075.
- U. Haug, D. Rothenbacher u. a.: Tumour M2-PK as a stool marker for colorectal cancer: comparative analysis in a large sample of unselected older adults vs colorectal cancer patients. In: British journal of cancer. Band 96, Nummer 9, Mai 2007, S. 1329–1334, ISSN 0007-0920. doi:10.1038/sj.bjc.6603712. PMID 17406361. PMC 2360192 (freier Volltext).
- Y. M. Shastri, M. Naumann u. a.: Prospective multicenter evaluation of fecal tumor pyruvate kinase type M2 (M2-PK) as a screening biomarker for colorectal neoplasia. In: Journal international du cancer. Band 119, Nummer 11, Dezember 2006, S. 2651–2656, ISSN 0020-7136. doi:10.1002/ijc.22243. PMID 16929517.
- J. E. Allison, I. S. Tekawa, L. J. Ransom, A. L. Adrain: A comparison of fecal occult-blood tests for colorectal-cancer screening. In: N Engl J Med. 334(3), 1996 Jan 18, S. 155–159. PMID 8531970.
- D. A. Lieberman, D. G. Weiss; Veterans Affairs Cooperative Study Group 380: One-time screening for colorectal cancer with combined fecal occult-blood testing and examination of the distal colon. In: N Engl J Med. 345(8), 2001 Aug 23, S. 555–560. PMID 11529208
- Yogesh Kumar, Niteen Tapuria, Naveed Kirmani, Brian R. Davidson: Tumour M2-pyruvate kinase: a gastrointestinal cancer marker. In: European Journal of Gastroenterology & Hepatology. 19, 2007, S. 265–276, doi:10.1097/MEG.0b013e3280102f78.
- P. D. Hardt, B. K. Ngoumou, J. Rupp, H. Schnell-Kretschmer, H. U. Kloer: Tumor M2-pyruvate kinase: a promising tumor marker in the diagnosis of gastro-intestinal cancer. In: Anticancer Res. 20(6D), 2000 Nov-Dec, S. 4965–4968. PMID 11326648.
- D. K. Dhar, S. W. Olde Damink, J. H. Brindley, A. Godfrey, M. H. Chapman, N. S. Sandanayake, F. Andreola, S. Mazurek, T. Hasan, M. Malago, S. P. Pereira: Pyruvate kinase M2 is a novel diagnostic marker and predicts tumor progression in human biliary tract cancer. In: Cancer. Band 119, Nummer 3, Februar 2013, S. 575–585, ISSN 1097-0142. doi:10.1002/cncr.27611. PMID 22864959. PMC 3492546 (freier Volltext).
Weiterführende Literatur
Pyruvatkinase M2 im Stuhl
- P. D. Hardt, S. Mazurek, M. Toepler, P. Schlierbach, R. G. Bretzel, E. Eigenbrodt, H. U. Kloer: Faecal tumour M2 pyruvate kinase: a new, sensitive screening tool for colorectal cancer. In: Brit. J. Cancer. 91, 2004, S. 980–984. PMID 15266315
- K. Koss, D. Maxton, J. A. Z. Jankowski: The potential use of fecal dimeric M2 pyruvate kinase (Tumor M2-PK) in screening for colorectal cancer (CRC). Abstract from Digestive Disease Week. May 2005; Chicago, USA.
- R. Mc Loughlin, E. Shiel, S. Sebastian, B. Ryan, H. J. O´Connor, C. O´Morain: Tumor M2-PK, a novel screening tool for colorectal cancer. Abstract from Digestive Disease Week. May 2005, Chicago/USA
- C. Tonus, G. Neupert, M. Sellinger: Colorectal cancer screening by non-invasive metabolic biomarker fecal M2-PK. In: World J Gastroenterol. 12, 2006, S. 7007–7011. PMID 17109496
- C. Tonus, G. Neupert, K. Witzel: The faecal tumour M2-PK screening test for invasive & pre-invasive colorectal cancer: estimated specificity & results as a function of age for a study population of 4854 volunteers. . In: Nowotwory J Oncol. 59, 2009, S. 32e-37e.
Pyruvatkinase M2 im Plasma
- H. Cerwenka, R. Aigner, H. Bacher, G. Werkgartner, A. El-Shabrawi, F. Quehenberger, H. J. Mischinger: TUM2-PK (pyruvate kinase type tumor M2), CA19-9 and CEA in patients with benign, malignant and metastasizing pancreatic lesions. In: Anticancer Res. 19, 1999, S. 849–852. PMID 10216504
- B. Kaura, R. Bagga, F. D. Patel: Evaluation of the pyruvate kinase isoenzyme tumor (Tu M2-PK) as a tumor marker for cervical carcinoma. In: J. Obstet. Gynaecol. Res. 30, 2004, S. 193–196. PMID 15210041
- C. W. Kim, J. I. Kim, S. H. Park, J. Y. Han, J. K. Kim, K. W. Chung, H. S. Sun: Usefulness of plasma tumor M2-pyruvate kinase in the diagnosis of gastrointestinal cancer. In: Korean J. Gastroenterol. 42, 2003, S. 387–393. PMID 14646575
- D. Lüftner, J. Mesterharm, C. Akrivakis, R. Geppert, P. E. Petrides, K. D. Wernecke, K. Possinger: Tumor M2-pyruvate kinase expression in advanced breast cancer. In: Anticancer Res. 20, 2000, S. 5077–5082. PMID 11326672.
- G. M. Oremek, S. Teigelkamp, W. Kramer, E. Eigenbrodt, K. H. Usadel: The pyruvate kinase isoenzyme tumor M2 (Tu M2-PK) as a tumor marker for renal carcinoma. In: Anticancer Res. 19, 1999, S. 2599–2601. PMID 10470201
- J. Schneider, H. Morr, H. G. Velcovsky, G. Weisse, E. Eigenbrodt: Quantitative detection of tumor M2-pyruvate kinase in plasma of patients with lung cancer in comparison to other lung diseases. In: Cancer Detec. Prev. 24, 2000, S. 531–535. PMID 11198266
- J. Schneider, G. Schulze: Comparison of Tumor M2-pyruvate kinase (Tumor M2-PK), carcinoembryonic antigen (CEA), carbohydrate antigens CA 19-9 and CA 724 in the diagnosis of gastrointestinal cancer. In: Anticancer Res. 23, 2003, S. 5089–5095. PMID 14981971
- S. Ugurel, N. Bell, A. Sucker, A. Zimpfer, W. Rittgen, D. Schadendorf: Tumor type M2 pyruvate kinase (TuM2-PK) as a novel plasma tumor marker in melanoma. In: Int. J. Cancer. 117, 2005, S. 825–830. PMID 15957165
- M. Ventrucci, A. Cipolla, C. Racchini, R. Casadei, P. Simoni, L. Gullo: Tumor M2-pyruvate kinase, a new metabolic marker for pancreatic cancer. In: Dig. Dis. Sci. 49, 2004, S. 1149–1155. PMID 15387337
- H. W. Wechsel, E. Petri, K. H. Bichler, G. Feil: Marker for renal carcinoma (RCC): The dimeric form of pyruvate kinase type M2 (Tu M2-PK). In: Anticancer Res. 19, 1999, S. 2583–2590. PMID 10470199
- B. Zhang, J. Y. Chen, D-D. Chen, G-B. Wang, P. Shen: Tumor type M2 pyruvate kinase epxression in gastric cancer, colorectal cancer and controls. In: World J. Gastroenterol. 10, 2004, S. 1643–1646. PMID 15162541
Wissenschaftlicher Hintergrund zur Pyruvatkinase M2
- S. Mazurek, C. B. Boschek, F. Hugo, E. Eigenbrodt: Pyruvate kinase type M2 and its role in tumor growth and spreading. In: Semin. Cancer Biol. 15, 2005, S. 300–308. PMID 15908230
Weblinks
- Die Tumor M2-PK als diagnostischer Biomarker (englisch)
- Das Pyruvatkinase-Isoenzym Typ M2 (englisch)
- Laborlexikon