Purkinjezelle
Purkinjezellen oder Purkyně-Zellen sind die charakteristischen großen multipolaren Nervenzellen mit stark verästeltem Dendritenbaum in der Rinde des Kleinhirns (Cortex cerebelli), deren Axone die Efferenzen der Kleinhirnrinde darstellen.
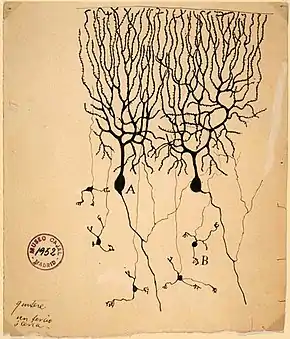

Analog dem Großhirn ist im Kleinhirn ebenfalls eine Rinde (Cortex) ausgebildet, mit nur dreischichtigem Aufbau. In der mittleren Kleinhirnrindenschicht, dem Stratum purkinjense, liegen die Zellkörper (Somata) von Purkinjezellen. Diese einschichtig im Abstand von 50–100 µm angeordneten Nervenzellen sind mit einem Perikaryon von rund 50–70 µm die größten Zellen im Kleinhirn. Sie zeichnen sich durch einen äußerst verzweigten Dendritenbaum aus, der spalierartig nahezu plan in der äußeren Kleinhirnrindenschicht, dem Stratum moleculare, ausgerichtet ist. Das menschliche Kleinhirn verfügt über etwa 15 Millionen Purkinjezellen mit je einem Axon.[1]
Axone der Purkinjezellen, die einzigen Ausgänge der Kleinhirnrinde, projizieren überwiegend auf die Kleinhirnkerne, daneben auf die lateralen Vestibulariskerne. Sie bilden hier jeweils inhibitorische Synapsen und nutzen dafür γ-Aminobuttersäure (GABA) als Neurotransmitter.[1][2] Dabei sind die Projektionen der Purkinje-Efferenzen auf die Kleinhirnkerne somatotopisch organisiert:[3] der Kopfbereich wird in den hinteren Anteilen, der Bereich von hinteren Extremitäten bzw. Schwanz in den vorderen Anteilen der Kerne repräsentiert.
Geschichte
Benannt sind diese Neurone nach ihrem Entdecker, dem böhmischen Physiologen Jan Evangelista Purkyně (1787–1869), der sie ebenso wie die Rindenschichtung des Kleinhirns 1837 erstmals beschrieb.[4][5]
Synaptische Verschaltung der Purkinjezellen
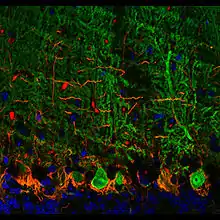
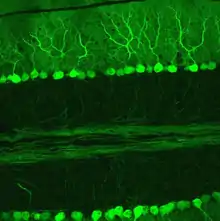
Der Cortex des Kleinhirns ist in drei Schichten gegliedert (siehe Abbildung oben). Ganz außen in der Molekularschicht (Stratum moleculare) verzweigt sich der Dendritenbaum der Purkinjezellen, darauf folgt die Purkinjezellschicht (Stratum purkinjense) mit deren Perikarya (Zellkörpern). Nach innen schließt die Körnerzellschicht (Stratum granulosum) mit den sehr zahlreichen Körnerzellen an, zwischen denen Axone von Purkinjezellen zu den im Kleinhirnmark gelegenen Kleinhirnkernen verlaufen.[6]
Erregende Eingänge
Seine Afferenzen erhält das Kleinhirn aus der Peripherie (u. a. von Muskelspindeln), dem Hirnstamm und der Großhirnrinde; die letztlich auf die Purkinjezellen konvergieren.[3]
Die Purkinjezellen erhalten zwei erregende Eingänge und zwar von dem Kletterfaser-System und dem Moosfaser-Parallelfaser-System; diese sind exzitatorisch und glutamaterg.
- Die Kletterfaser entspringt der unteren Olive, einem Kerngebiet in der Medulla oblongata. Ihren Namen bezieht sie daher, dass sie den im Stratum moleculare befindlichen Dendritenbaum der Purkinjezelle aufsteigend umschlängelt: Besonders zu primären Dendriten im proximalen, also näher zum Soma gelegenen Teil, bildet sie besonders starke Synapsen mit der Purkinjezelle aus.
Im Gegensatz zum Parallelfaser-Eingang – der eine erhebliche räumliche Summation zur Auslösung eines Aktionspotentials (AK) benötigt – ist die Wahrscheinlichkeit der Transmitterfreisetzung an den präsynaptischen Endigungen bei Eintreffen eines AK sehr hoch (schon ein einzelnes Kletterfaser-Aktionspotenzial erregt die Purkinjezelle überschwellig).[6]
Eine Purkinje-Zelle hat synaptische Kontakte mit nur einer Kletterfaser; hingegen konvergieren auf sie etwa 100 000 Parallelfasern.[6] Kurz nach der Geburt sind die meisten Purkinjezellen zunächst noch von mehreren Kletterfasern innerviert. Durch Elimination überzähliger Synapsen bildet sich während der Entwicklung die typische Monoinnervation der Purkinjezellen durch jeweils eine Kletterfaser heraus.
- Die Moosfasern (Axone von Neuronen in Hirnstammkernen und Rückenmark) und Parallelfasern (Axone der Körnerzellen in der Körnerzellschicht)
Die Moosfasern (ca. 50 Millionen) sind Axone von Neuronen in Hirnstammkernen und Rückenmark. Sie vermitteln Information aus Großhirnrinde und aktivieren die Körnerzellen, deren Axone die Parallelfasern sind, die wiederum die Purkinje-Zellen erregen. Eine Parallelfaser hat jeweils nur eine Synapse pro Purkinje-Zelle.[6]
Diese steigen in die Molekularschicht auf und gabeln sich dort im rechten Winkel. Der Teil des Körnerzellaxons nach der Gabelung wird als Parallelfaser bezeichnet. Diese Fasern durchziehen in paralleler Anordnung (daher der Name) die Molekularschicht und treffen im rechten Winkel auf den Dendritenbaum der Purkinjezellen. Jede Parallelfaser innerviert viele Purkinjezellen, bildet dabei aber selten mehr als eine, nie mehr als zwei Synapsen. Das heißt, das Axon endet nicht am Ort der Synapse. Diese Art der Innervation wird auch als en-passant-Synapse bezeichnet. Jede Purkinjezelle besitzt mehr als 100 000, je nach Quelle bis zu 200 000, Parallelfasersynapsen. Die einzelne Parallelfasersynapse ist "schwach" im Vergleich zur Kletterfasersynapse. Die Wahrscheinlichkeit für Transmitterfreisetzung im präsynaptischen Teil ist also gering.
Hemmende Eingänge
Die Purkinjezelle wird in der Molekularschicht wesentlich von zwei Interneurontypen hemmend innerviert: den Korbzellen und den Sternzellen.[1]
Im proximalen Teil des Dendritenbaums der Purkinjezellen sind das besonders die Korbzellen, mehr distal vor allem die Sternzellen. In der Körnerzellschicht finden sich die Golgi-Zellen (multipolare Ganglienzellen vom Typ Golgi, die als große Körnerzellen der Kleinhirnrinde imponieren) als weiterer Interneurontyp. Die Synapsen dieser drei Interneuronen sind GABAerg, das heißt, sie benutzen GABA als Transmitter.
Vor kurzem wurde entdeckt, dass entgegen bisherigen Annahmen auch die Lugarozellen in der Körnerzellschicht Synapsen mit der Purkinjezelle hat. Diese sind allerdings nur unter bestimmten Voraussetzungen aktiv. Zum Beispiel brauchen sie die Anwesenheit des Neurotransmitters Serotonin.[7][8]
Ausgang der Purkinjezelle
Allein die Axone von Purkinjezellen stellen die Ausgänge der Kleinhirnrinde dar. Aktionspotentiale einer Purkinjezelle werden im Axon am ersten Ranvierschen Schnürring generiert, ca. 75 µm vom Soma entfernt. Die Axonterminalen schütten GABA als Transmitter aus und wirken damit hemmend auf die ihnen nachgeordneten Neuronen (inhibitorisches PSP). Diese liegen überwiegend im Komplex der Kleinhirnkerne im Mark der Kleinhirnhemisphäre jeder Seite
und darüber hinaus im Nucleus vestibularis laleralis.[6]
Dornenfortsätze
Der Dendritenbaum der Purkinjezellen ist, wie auch der mancher anderer zentraler Neuronen, mit Dornenfortsätzen – im Englischen spines – besetzt, und dies etwa fünfmal dichter als bei Pyramidenzellen. Auf einem Dornenfortsatz an Dendriten von Purkinjezellen befindet sich die postsynaptische Membranregion einer erregenden Synapse. Die GABAergen hemmenden Synapsen enden nicht an Dornen.
Die Dornenfortsätze einer Purkinjezelle unterscheiden sich darin, ob sie von der Kletterfaser oder den Parallelfasern innerviert werden. Kletterfaser-Dornen befinden sich vor allem im proximalen (näher zum Soma gelegenen) Teil des Dendritenbaumes, während Parallelfaser-Dornen vor allem die dünnen distalen (weiter vom Soma entfernten) Bereiche des Dendritenbaumes besetzen.
Dornenfortsätze für Kletterfasern entwickeln sich anders als die für Parallelfasern. Die Anlage der Parallelfaser-spines braucht keine synaptische Aktivität. Sie ist wahrscheinlich in der Entwicklung des Neurons intrinsisch vorgegeben. Das Wachstum von Kletterfaser-spines dagegen benötigt die Anwesenheit und Aktivität funktioneller Parallelfasersynapsen und wird andererseits durch die Aktivität der Kletterfaser gehemmt.
Rezeptoren und Ionenkanäle in Purkinjezellen
An den erregenden glutamatergen Kletter- und Parallelfasersynapsen exprimieren Purkinjezellen Glutamatrezeptoren. Bemerkenswerterweise verfügen reife Purkinjezellen nicht über NMDA-Rezeptoren. Die einzigen ionotropen Glutamatrezeptoren in Purkinjezellen sind AMPA-Rezeptoren. Da letztere über die GluR2-Untereinheit verfügen, ist ihre Calcium-Permeabilität gering.
Purkinjezellen exprimieren als einzige Neuronen im ZNS den GluRδ2-Rezeptor. Die Aminosäuresequenz dieses Rezeptors lässt vermuten, dass es sich um einen ionotropen Glutamatrezeptor handelt. Trotzdem wurde bisher weder eine direkte Bindung von Glutamat an diese Untereinheit, noch ihr Einbau in einen bekannten Glutamatrezeptor nachgewiesen. GluRδ2-Rezeptoren befinden sich vor allem an den Parallelfasersynapsen der Purkinjezellen. Bei Fehlen des Rezeptors kommt es zu Störungen der synaptischen Plastizität auf zellulärer Ebene und zu Störungen der motorischen Kontrolle und des motorischen Lernens auf Verhaltensebene. Viele andere postsynaptische Proteine stehen in Wechselwirkung mit der GluRδ2-Untereinheit. Der GluRδ2-Rezeptor hat also eine Schlüsselrolle für die Funktion des Kleinhirns, auch wenn seine Funktion und sein Wirkungsmechanismus noch ungeklärt sind.
Sowohl an Parallelfaser- als auch an Kletterfasersynapsen sind in Purkinjezellen perisynaptisch (also am Rand, nicht im Zentrum der Synapse) metabotrope Glutamatrezeptoren lokalisiert, und zwar überwiegend der Subtyp mGluR1.
Wie in allen Neuronen sind auch in Purkinjezellen spannungsaktivierte Natriumkanäle für die Entstehung und Weiterleitung von Aktionspotentialen zuständig. Sie werden in erster Linie im Soma und Axon der Purkinjezelle exprimiert. Im Dendritenbaum nimmt ihre Dichte mit zunehmendem Abstand vom Soma schnell ab. Aus diesem Grund dringt im Gegensatz zu anderen Neuronentypen wie zum Beispiel Pyramidenzellen im Hippocampus das Aktionspotential in Purkinjezellen nicht stark in den Dendritenbaum ein. In den Purkinjezellen von Säugetieren sind vor allem die Natrium-Kanäle Nav1.1, Nav1.2 und Nav1.6 exprimiert.
Im Dendritenbaum und Soma der Purkinjezellen finden sich spannungsabhängige Calciumkanäle, die zum größten Teil zum P/Q-Typ gehören. Diese bewirken bei starker Depolarisation (wie zum Beispiel einem Aktionspotential oder synaptischer Aktivität von Kletter- und/oder Parallelfasern) einen Einstrom von Calciumionen in die Zelle.
In der Membran des endoplasmatischen Retikulums (ER) von Purkinjezellen befinden sich ligandenaktivierte Calciumkanäle, und zwar sowohl IP3-Rezeptoren als auch Ryanodin-Rezeptoren. Beide setzen bei ihrer Aktivierung Calcium-Ionen aus dem ER-Calciumspeicher in das Cytosol frei und erhöhen dort die Konzentration sogenannter freier Calcium-Ionen. Von den verschiedenen IP3-Rezeptoren wird in Purkinjezellen in erster Linie der Subtyp 1 (IP3R1) exprimiert, und zwar im Vergleich zu anderen Zelltypen in mindestens 10-facher Menge.
Spontanaktivität der Purkinjezellen
Purkinjezellen zeichnen sich durch eine hohe Spontanaktivität aus. Darunter versteht man, dass sie Aktionspotentiale unabhängig davon generieren, ob sie von Kletter- oder Parallelfasern erregt werden. Sie feuern mit einer Frequenz von ca. 50–150 Hz. Als Rhythmusgeneratoren dienen dabei vor allem Calcium-aktivierte Kaliumkanäle, die sogenannten BK-Kanäle.[9]
Einzelnachweise
- Theodor H. Schiebler, Horst-W. Korf: Anatomie: Histologie, Entwicklungsgeschichte, makroskopische und mikroskopische Anatomie, Topographie. 10., vollst. überarb. Auflage. Steinkopff, 2007, ISBN 978-3-7985-1770-7, S. 786.
- Robert F. Schmidt, Florian Lang, Manfred Heckmann (Hrsg.): Physiologie des Menschen: mit Pathophysiologie: mit Pathophysiologie mit Repetitorium. 31., neu bearb. u. aktual. Auflage. Springer, Berlin/ Heidelberg 2010, ISBN 978-3-642-01650-9, S. 167/168.
- Florian Lang, Philipp Lang: Basiswissen Physiologie. 2., vollständig neu bearb. und aktual. Auflage. Springer, Berlin 2008, ISBN 978-3-540-71401-9, S. 359.
- Stanley Finger: Origins of Neuroscience: A History of Explorations Into Brain Function. Reprint. Oxford University Press, 2001, ISBN 0-19-514694-8, S. 43.
- Walter Kirsche: Jan Evangelista Purkyně 1787–1868. Ein Beitrag zur 200. Wiederkehr seines Geburtstages. Akademie-Verlag, Berlin 1989 (= Sitzungsberichte der Akademie der Wissenschaften der DDR. Jahrgang 1988, Nr. 5/N), ISBN 3-055-00520-1, S. 28 f.
- Rainer Klinke, Hans-Christian Pape, Armin Kurtz, Stefan Silbernagl: Physiologie: Lehrbuch. 6., vollständig überarbeitete Auflage. Thieme, Stuttgart 2009, ISBN 978-3-13-796006-5, S. 769/770.
- Funktionelle Architektur der Kleinhirnkerne der Ratte. (PDF; 1,7 MB) Dissertation. Uni Tübingen.
- The Neuroscientist - The Lugaro Cell Is a Major Effector for Serotonin in the Cerebellar Cortex (PDF; 1,2 MB) – Artikel gehostet bei princeton.edu
- BK Channels Control Cerebellar Purkinje and Golgi Cell Rhythmicity In Vivo – Artikel bei plosone.org
Literatur (Kapitel)
- Theodor H. Schiebler, Horst-W. Korf: Anatomie: Histologie, Entwicklungsgeschichte, makroskopische und mikroskopische Anatomie, Topographie. 10., vollst. überarb. Auflage. Steinkopff, 2007, ISBN 978-3-7985-1770-7, S. 786–791.
- Rainer Klinke, Hans-Christian Pape, Armin Kurtz, Stefan Silbernagl: Physiologie: Lehrbuch. 6., vollständig überarbeitete Auflage. Thieme, Stuttgart 2009, ISBN 978-3-13-796006-5, S. 769/770.
Weblinks
- Eintrag zu Purkinje-Zelle im Flexikon, einem Wiki der Firma DocCheck
- DIE DENDRITENENTWICKLUNG VON PURKINJEZELLEN DURCH GLUTAMATREZEPTORGESTEUERTE SIGNALWEGE (PDF; 2,0 MB) – Dissertation bei db-thueringen.de
- Organization of spines on the dendrites of Purkinje cells – Artikel über die Organisation der dendritischen Spines bei Fischen und Säugern bei pnas.org (engl.)
- Dendritic Spines of Rat Cerebellar Purkinje Cells: Serial Electron Microscopy with Reference to Their Biophysical Characteristics (PDF; 2,3 MB) – Artikel über dendritische Spines bei Ratten bei jneurosci.org (engl.)