Plasmafraktionierung
Plasmafraktionierung ist ein Verfahren zur Gewinnung von Proteinen aus menschlichem Blutplasma. Dabei wird das Plasma mit Hilfe verschiedener physikalischer Methoden (Fällung, Filtration, Adsorption, Elektrophorese) in einzelne Fraktionen aufgetrennt und gereinigt. Zunutze macht man sich bei diesem Verfahren die unterschiedlichen Löslichkeiten der verschiedenen Plasmaproteine bei wechselnden pH-Werten, Temperaturen und Ionenstärken sowie das variierende Adsorptionsverhalten an festen Trägersubstanzen.
Präparative Plasmafraktionierung wird in Anlagen, die zur Verarbeitung von mehreren tausend Litern ausgelegt sind, also in industriellem Maßstab, durchgeführt. Aus den isolierten Proteinen hergestellte Produkte (Plasmaprodukte) dienen als Medikamente zur Behandlung von angeborenen und erworbenen Störungen der Blutgerinnung und der Immunabwehr, sowie bei Schocks durch großen Blutverlust oder bei schweren Verbrennungen und weiteren Krankheitszuständen.
Für diagnostische Zwecke trennt man Plasmaproteine durch Anwendung der Elektrophorese auf.
Plasmagewinnung
Plasma für die Plasmafraktionierung wird meist durch Plasmapherese gewonnen. Aufgrund des hohen Bedarfs an Plasma von gesunden Spendern wird diese Methode der Vollblutspende vorgezogen. Plasmapherese erlaubt kürzere Spendenintervalle und ein höheres Spendenvolumen. Die in einen Kunststoffbeutel entnommene Plasmaspende wird bei −25 °C eingefroren und gelagert. Im Plasma gelöste Proteine sind verantwortlich für die Blutgerinnung, die Immunabwehr, den kolloidosmotischen Druck, den Stofftransport und weitere lebensnotwendige Aufgaben.
Fraktionierung
Kryopräzipitation
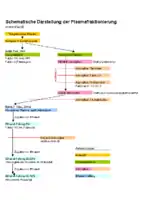
Mehrere tausend Plasmabeutel werden im noch tiefgefrorenen Zustand aufgeschnitten und gemeinsam in einem großen, temperierbaren Behälter langsam aufgetaut. Die Temperatur im so entstehenden Plasmapool beträgt etwa +1 °C.
Wie Judith Pool[1] Mitte der 1960er Jahre fand, lösen sich dabei aber nicht alle im Plasma enthaltenen Proteine sofort wieder auf. Es bildet sich ein trüber Niederschlag (Kryopräzipitat), der durch Zentrifugieren vom übrigen Plasma getrennt werden kann. Der Überstand, das kryoarme Plasma, enthält nach diesem Arbeitsschritt noch zahlreiche Proteine und ist kein Abfallprodukt.
Im Kryopräzipitat sammeln sich die für die Blutgerinnung wichtigen Proteine Faktor VIII, Von-Willebrand-Faktor und Fibrinogen an. Die Geschwindigkeit und der Temperaturverlauf beim Auftauen entscheiden über die Qualität des Kryopräzipitats. Aus dem Kryopräzipitat werden die genannten Proteine durch weitere Fällungen und chromatographische Reinigungsschritte isoliert und durch Ultrafiltration konzentriert.
Aus dem kryoarmen Plasma werden mit Hilfe der DEAE®-Adsorption die Faktoren des Prothrombinkomplexes (Faktor II, Faktor VII, Faktor IX und Faktor X) und durch QAE®-Adsorption der C1-Inaktivator isoliert.
Ethanolfraktionierung
Doch auch nach diesen Prozessschritten befinden sich nutzbare Proteine im kryoarmen Plasma, die durch Anwendung der Cohn-Extraktion gewonnen werden.
Edwin Joseph Cohn hat dieses Verfahren in den 1940er Jahren entwickelt. Dabei wird dem kryoarmen Plasma Ethanol in immer höheren Konzentrationen zugefügt und die Temperatur unter 0 °C abgesenkt. Bei einer Ethanolkonzentration von 8 % wird unter anderem der Faktor XIII unlöslich und fällt in Form eines Niederschlags (Präzipitat) aus. Das Präzipitat kann durch Zentrifugation oder Filtration abgetrennt werden. Es ist ein stabiles Zwischenprodukt (Intermediat) und tiefgefroren einige Wochen lagerfähig. Zur Weiterverarbeitung wird das Präzipitat aufgetaut und in einem Puffer gelöst. Aus diesem wird dann durch Fällung und Chromatographie der Faktor XIII aufgereinigt. Aus dem Überstand der 8 % Ethanolfällung wird durch Adsorption an ein Heparinharz Antithrombin III gewonnen.
Durch weiteres Hinzufügen von Ethanol präzipitieren bei einer Konzentration von 20 bis 25 % die Immunglobuline. Aus diesem Intermediat kann ein hyperimmunes Globin gewonnen werden. Durch geeignete Aufreinigung (z. B. Affinitätschromatographie) ist es aber auch möglich, spezifische Antikörper zu isolieren. So können passive Impfstoffe gegen viele Krankheitserreger bereitgestellt werden, wie zum Beispiel Hepatitis B, Diphtherie, Tetanus und Tollwut. Am Ende der Cohn-Fraktionierung wird die Konzentration des Ethanols auf 40–42 % eingestellt. Dadurch wird Albumin unlöslich und kann abgetrennt werden.
Salzfraktionierung
Bei dieser Art der Fraktionierung wird die Ionenstärke in der Proteinlösung durch Salzzugabe (Ammoniumsulfat-Fällung, Natriumsulfat, Alanin) geregelt.
Sicherheit
Spenderauswahl und -kontrolle
Blutplasma augenscheinlich gesunder Spender dient als Ausgangsmaterial für die Plasmafraktionierung. Bereits durch die Auswahl geeigneter Spender soll das Risiko der Übertragung von Krankheiten von Anfang an minimiert werden. Zudem wird der Gesundheitszustand der Spender ab der Spende für einen bestimmten Zeitraum überwacht, um zum Zeitpunkt der Spende nicht erkannte Risiken oder Erkrankungen bei der Weiterverwendung der Spende zu berücksichtigen. Zu diesem Zweck wird gespendetes Blutplasma nicht sofort weiterverarbeitet, sondern für eine definierte Zeit quarantänisiert.
Spendenkontrolle
Aber wie jedes Material biologischen Ursprungs, birgt auch Blutplasma trotzdem das Risiko einer Krankheitsübertragung in sich. Jede einzelne Spende für sich und später der Plasmapool werden mit hoch empfindlichen Methoden auf Krankheitserreger, vor allem Hepatitis B und HIV, untersucht.
Aufarbeitungsprozess
Durch den Prozess der Plasmafraktionierung findet eine Abreicherung möglicherweise vorhandener Krankheitserreger statt. Eine komplette, sichere Eliminierung oder Inaktivierung kann das Verfahren jedoch nicht leisten. Deshalb müssen in der Plasmafraktionierung an geeigneten Stellen Maßnahmen zur Virusreduktion (physikalische Abtrennung von Viren durch Fällung oder Filtration) bzw. Virusinaktivierungsschritte (Zerstörung von Viren) durchgeführt werden. Etabliert ist seit den 1960er Jahren die Pasteurisierung bei +60 °C über 10 Stunden und seit den 1990er Jahren zusätzlich die Nanofiltration. Voraussetzung für diese Maßnahmen sind hitzestabile Intermediate und im Fall der Nanofiltration eine ausreichende Verdünnung der enthaltenen Stoffe, deren Molekulargröße darüber hinaus auch klein genug sein muss, um filtriert werden zu können.
Eine weitere Möglichkeit der Virusinaktivierung bietet das Solvent-Detergent-Verfahren (S/D). Dabei werden einem geeigneten Intermediat im Prozessverlauf virusinaktivierende Chemikalien, beispielsweise Tri-n-Butyl-Phosphat (TNBP) und Triton X-100 hinzugefügt. Nach Ablauf einer festgelegten Einwirkzeit werden diese dann wieder extrahiert und verbleiben also nicht (oder nur in Spuren) im Produkt.
Die Vorschriften verlangen im Herstellprozess eines jeden Plasmaproduktes mindestens zwei Virusinaktivierungsschritte. Diese müssen in Testläufen, sogenannten Virus-Spike-Versuchen, ihre Wirksamkeit beweisen. Dazu werden die Produktionsbedingungen im Labor nachgestellt (Down-Scale) und das betreffende Intermediat mit dem zu inaktivierenden Virus versetzt (Spiken). Nach Durchführung der Virusinaktivierung wird der Erfolg mithilfe entsprechender Tests überprüft.
Ist eine Methode im Labor wiederholt und zuverlässig durchgeführt worden, wird sie in den Produktionsmaßstab umgesetzt (Up-Scale). Hier werden dann keine Spike-Versuche mehr durchgeführt, denn diese würden die Produktionsausrüstung kontaminieren und zu einem unkalkulierbaren Risiko führen.
Umso mehr wird auf eine genaue Prozess-Kontrolle geachtet. So wird zum Beispiel während der Pasteurisierung die Temperatur im Pasteurisierungsbehälter genauestens überwacht. Diese darf die im Down-Scale festgelegten Grenzen nicht unterschreiten. Andernfalls ist eine sichere Inaktivierung eventuell vorhandener Viren nicht gewährleistet. Die Temperatur darf die obere Grenze aber auch nicht überschreiten. Dann könnten die empfindlichen Produkte zerstört werden.
Nach Angaben des Arbeitskreises Blut am Robert Koch-Institut (RKI) besteht heute kein Risiko mehr, sich über Plasmaprodukte mit HIV anzustecken.
In Deutschland überwacht das Paul-Ehrlich-Institut (PEI) in Langen die Herstellung von Plasmaprodukten. Jede einzelne Charge eines Produktes unterliegt der Freigabe durch das PEI. Neue Produkte und Herstellungsmethoden sowie Änderungen bereits genehmigter Herstellungsmethoden bedürfen ebenfalls einer Herstellerlaubnis durch das PEI. In den USA, dem wohl wichtigsten Absatzmarkt für Plasmaprodukte, übernimmt diese Aufgabe die Food and Drug Administration (FDA).
Effizienz des Verfahrens
Das Ziel der Plasmafraktionierung sind reine, konzentrierte Proteinlösungen, deren Funktion durch möglichst schonende Behandlung und Konservierung (meist Gefriertrocknung) erhalten bleiben soll. Teile des Verfahrens sind heute über 60 Jahre alt und in der Vergangenheit nur wenig verändert worden.
Durch das immer knappe und teure Ausgangsmaterial kommt es zur Forderung nach einer effizienteren Durchführung der Plasmafraktionierung. So soll aus möglichst wenig Ausgangsmaterial immer mehr Produkt hergestellt werden (Ausbeutesteigerung). Doch dieser Forderung kann oft nur in einem engen Rahmen entsprochen werden. So können vermeintliche Verbesserungen im Herstellverfahren zwar dessen Reinheit erhöhen und die Ausbeute steigern, jedoch darf dabei kein Missverhältnis zu stabilisierenden Hilfsproteinen entstehen. Andernfalls kann die biologische Wirksamkeit der aktiven Proteine vermindert werden.
Literatur
- A. Gröner, S.C. Martin, Viruseliminierung durch Reinigungsschritte während der Produktion von Plasmapräparaten. Die gelben Hefte 38: 81 (1998), http://www.diegelbenhefte.de/
- P.F.W Strengers, W.G. Van Aken u. a., Blut – Von der Magie zur Wissenschaft. Spektrum Akademischer Verlag (1996), ISBN 3-86025-364-6
- Humanes Immunschwächevirus (HIV); Stellungnahme des Arbeitskreises Blut des Bundesministeriums für Gesundheit und Soziale Sicherung, PDF-File
Einzelnachweise
- Gedenkschrift für Judith Pool (englisch) (Archivierte Kopie (Memento des Originals vom 28. März 2012 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. PDF 15 kB).