Photosynthetisch aktive Strahlung
Als photosynthetisch aktive Strahlung (engl.: photosynthetically active radiation, kurz PAR oder PhAR) ist jene elektromagnetische Strahlung im Bereich des Lichtspektrums definiert, den phototrophe Organismen hauptsächlich bei der Photosynthese nutzen. Er deckt sich weitgehend mit dem Bereich der für Menschen sichtbaren Strahlung mit einer Wellenlänge zwischen 380 nm und 780 nm. In diesem Bereich liegen in etwa 50 Prozent der Globalstrahlung[2].
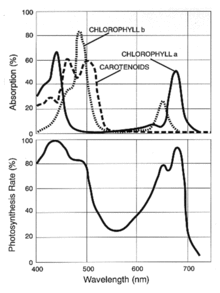
Der photosynthetische Wirkungsgrad ist ein Wirkungsgrad und von der Wellenlänge des Lichts und vom Absorptionsverhalten der photosynthetisch aktiven Stoffe abhängig. Seine spektrale Verteilung ist von Interesse, derartige Darstellungen und Wirkungen werden Aktionsspektrum (der Photosynthese), Wirkspektrum (der Photosynthese) oder Wirkungsspektrum der Photosynthese genannt.[3]
Für jede Pflanzenart kann ein eigenes Wirkungsspektrum dieser Lichtstrahlen mithilfe einer Assimilationskammer ermittelt werden. Dabei werden CO2-Verbrauch oder O2-Entstehung bei Bestrahlung der Pflanzen mit Licht unterschiedlicher Wellenlänge gemessen. Die bisher ermittelten wellenlängenabhängigen Photosyntheseraten einzelner Pflanzenarten beruhen auf unterschiedlichen Gehalten und unterschiedlichen Absorptionsmaxima der photosensitiven Chromatophoren (beispielsweise Chlorophylle, Carotinoide, Phycoerythrin oder Phycocyanin), den unterschiedlichen Methoden zur Ermittlung und dem Stand der technischen Entwicklung der Messgeräte.
Die Erforschung der PAR war in den Anfängen Grundlagenforschung zur Pflanzenanzucht. Seitdem vermehrt Pflanzen unter ausschließlich künstlicher Beleuchtung gezogen werden, kamen ökonomische Gründe dazu, so wenig Energie wie möglich für „nutzlose“ Beleuchtung zu verschwenden.
Angabe und Maßeinheiten
Die PAR kann in Abhängigkeit verschiedener Größen angegeben werden:[4]
- als PAR-Bestrahlungsstärke eingestrahlte Lichtenergie (im Spektralbereich 400 bis 700 nm) pro Zeit und Fläche.
- als PAR-Photonen-Fluss (PPF von englisch Photosynthetic Photon Flux): Anzahl eingestrahlter Photonen im Spektralbereich 400 bis 700 nm pro Zeit
- als PAR-Photonen-Flussdichte (PPFD von englisch Photosynthetically Active Photon Flux Density) Anzahl eingestrahlter Photonen im Spektralbereich 400 bis 700 nm pro Zeit und Fläche.
Forschungsgeschichte
Theodor Wilhelm Engelmann (1843–1909) zeigte mit seinem Bakterienversuch, wie die Sauerstoffbildung bei der oxygenen Photosynthese in verschiedenen Bereichen des Lichtspektrums lichtabhängig ist.[5]
Forschungen ab der letzten Hälfte des 19. Jahrhunderts ergaben als gemeinsames Resultat, dass alles mit menschlichem Auge erkennbare Licht auch imstande ist, Kohlendioxydaufnahme und Sauerstoffausscheidung in chlorophyllführenden grünen Pflanzen hervorzurufen.[6]
W.B. Hoover[7] untersuchte die PAR am Beispiel Weizen und schuf 1937 eine PAR-Kurve mit der prozentualen Photosyntheserate auf der Ordinate und Wellenlänge auf der Abszisse.[8] Govindjee publizierte 1961 eine Grafik der PAR bei der die prozentuale Photosyntheserate auf der Ordinate gegen die Wellenlängen auf der Abszisse aufgetragen ist.[1]
Außerdem publizierte McCree verschiedene Artikel über die photosynthetische Lichtabsorption von 22 unterschiedlichen Feldfrüchten, die im Freiland und in Versuchskammern aufgezogen wurden. Je nach der arttypischen Pigmentzusammensetzung in den photosensitiven Chromatophoren absorbieren Pflanzen Licht unterschiedlicher Wellenlängen unterschiedlich stark. Dies ist bei künstlicher Beleuchtung wichtig, da verschiedene Leuchtmittel verschiedene Emissionsspektren haben, die überdies bedeutend schmaler sind als das Emissionsspektrum der Sonne.
Zugleich zog McCree den Schluss, dass der Bereich zwischen 400 und 700 nm im Wesentlichen dem Wellenlängenbereich der photosynthetisch aktiven Strahlung entspricht.[9]
Shinji Tazawa veröffentlichte 1999 Absorptionsspektren von 61 unterschiedlichen Pflanzenarten und leitete davon seine Version einer einheitlichen Kurve der PAR ab. Tazawa hat darin die Ergebnisse von Katsumi Inada,[10] einem japanischen Forscher und von Keith J. McCree zusammengefasst.[11]
McCree-Kurve
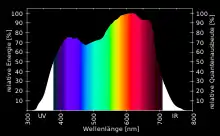
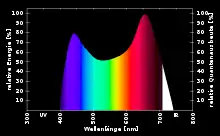
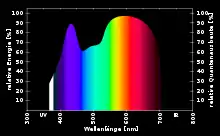
Keith J. McCree (1927–2014)[12][13] maß 1972 für 22 verschiedene Nutzpflanzen photosynthetische Wirkspektren. Daraus entwickelte er eine einheitliche Wirkspektrumkurve der PAR, die sogenannte McCree-Kurve[9](Fraunhoferlinien werden darin nicht erfasst). Ebenso wird die von ihm vorgeschlagene Darstellungsform für PAR-Diagramme als McCree-Kurve bezeichnet,[14] eine Darstellung mit der Wellenlänge auf der waagerechten und der relativen Quantenausbeute in % oder Werten zwischen 0 und 1 auf der senkrechten Achse. Die Quantenausbeute ist dabei relativ zur höchsten Quantenausbeute im ermittelten Spektrum, die dann als 100 % oder 1 angegeben wird.
Die Quantenausbeute der Photosynthese ist dabei das Verhältnis zwischen den von einer Pflanze zur Photosynthese genutzten Photonen und den von der Pflanze absorbierten Photonen. Die photosynthetische Aktivität wird dabei anhand der Differenz der Abbaurate von CO2 im Hellen und Dunklen gemessen.
Hierbei sind:
- : Konstante mit der Einheit
- : Konstante zur Konversion von in absorbierte Einstein
- : CO2-Abbaurate im Licht
- : CO2-Abbaurate im Dunkeln
- : Wellenlänge
- : Bestrahlungsstärke
- : Photonenrate ohne Probe
- : Photonenrate mit Probe
Die relative Quantenausbeute bei einer Wellenlänge ist das Verhältnis der Quantenausbeute bei dieser Wellenlänge zum Maximalwert der Quantenausbeute innerhalb des photosynthetisch aktiven Bereichs.[9]
Mit einer McCree-Kurve wird das Spektrum der absorbierten, photosynthetisch aktiven Strahlung dargestellt. Weil die Zusammensetzung der Chromatophoren einer Pflanze artspezifisch ist, besitzt jede Art ihr eigenes McCree-Diagramm, aus deren Ähnlichkeit McCree 1972 seine Variante einer einheitlichen Kurve der PAR ableitete.
Eine PAR-Kurve (nach McCree) zeigt, wie viel Prozent der die Pflanze erreichenden und absorbierten Strahlung einer bestimmten Wellenlänge Prozesse der Photosynthese auslösen. Der Rest des eingestrahlten Lichtes wird reflektiert, absorbiert und in Wärme oder beispielsweise auch Fluoreszenz umgewandelt oder transmittiert.
Messmethode von McCree
McCree isolierte einzelne Blätter der Pflanzen und platzierte sie gewässert in einer Assimilationskammer, in der Temperatur und Kohlendioxid-Gehalt (mit einem Infrarot-Gasanalysator) gemessen wurden (siehe auch Infrarotspektroskopie). Die mit dieser Apparatur und Prozedur gemessenen Photosyntheseraten waren überraschend reproduzierbar („surprisingly reproducible“.[9])
Mittels eines Monochromators wurden die Pflanzen mit monochromen Licht beleuchtet und die Bestrahlungsstärke gemessen, Datenpunkte für die Kurve der Photosyntheserate wurden für einzelne Wellenlängen zwischen 350 und 750 nm in Intervallen von 25 nm Größe ermittelt. Dann wurde mittels eines Photomultiplier-Photometers die spektrale Absorption des Blattes in Intervallen von 20 nm gemessen. Dazu wurde die Lichtreflexion einer mit Bariumsulfat beschichteten Fläche ohne und mit Beschattung durch das Blatt gemessen und aus den Differenzwerten die Absorption und daraus unter Berücksichtigung der Photosyntheseraten die Quantenausbeute Q berechnet.[9]
Interpretation der Kurven und Kritik
Es wurde kritisiert, dass mit der Messmethode nur die Absorption eines einzelnen Blattes gemessen wurde und nicht die Absorption einer ganzen Pflanze. Wegen der dabei gemessenen geringen Absorption grüner Lichtstrahlen (der sogenannten Grünlücke) würden oft grünen Lichtstrahlen biologische Funktionen bei der Photosynthese abgesprochen, was bezweifelt wird. Die geringe Absorption eines einzelnen Blattes werde durch die stärkere Absorption eines geschlossenen Blätterdachs wettgemacht. Bei der Bewertung von McCree-Kurven von Leuchtmitteln ist zudem zu berücksichtigen, dass Pflanzen das Licht nicht nur zur Photosynthese, sondern auch für die Photomorphogenese (die Steuerung der Gestalt, Streckung und Entwicklung) benötigen. Während für die Photosynthese Licht mit Wellenlängen zwischen 400 und 700 nm genutzt wird, nutzen die Phytochrome für die Photomorphogenese Wellenlängenbereiche zwischen 320 nm (nahes UV-Licht) bis 800 nm (nahes Infrarotlicht)[15], nach anderer neuerer Quelle bis 720 nm[16]. Siehe dazu Fotorezeptoren bei Pflanzen.
Moderne mobile Spektralphotometer erlauben heutzutage auch die Aufnahme unter einem Blätterdach.
Nachdem aufgezeigt wurde, dass die Photosynthese mit einer Mischung verschiedener Lichtfarben besser funktioniert als bei Bestrahlung mit monochromatischem Licht (Emerson-Effekt), also eine wechselseitige Beeinflussung gegeben ist, wurde 2009 vorgeschlagen, für die Ermittlung von PAR-Kurven die Quantenausbeute von zusätzlichem monochromatischen Licht unterschiedlicher Wellenlängen unter weißer Grundbeleuchtung zu messen[17]. Die photosynthetische Quantenausbeute von grünem Licht sei der von rotem Licht vergleichbar und größer als die von blauem Licht[17].
Praktische Versuche führten bereits 2004 zu mehr Pflanzenwachstum und Biomasse nach Zugabe von grünem Licht (500 bis 600 nm).[18] Zudem kann die Ausrichtung der Blätter (in Richtung der Lichtquelle) mithilfe von Grünlicht aufgrund der Photomorphogenese zu mehr Biomasse führen.[19]
McCree untersuchte die Auswirkungen monochromatischen Lichts auf einzelne Blätter oder Blatteile um die Wirkung unterschiedlicher Wellenlängen auf unterschiedliche Pflanzen isoliert zu erforschen. Heutzutage werden ganze Pflanzen in längeren Praxistests in Einzelkammern mit Licht bestimmter Pflanzenlampen bestrahlt und die Ergebnisse der Photosynthese eher durch Vergleichen der erreichten Biomasse ermittelt.[20]
PAR-Kurven von emittierenden Geräten
Zur Ermittlung der PAR ohne Photosynthese wird ein mit Filtern bestückter Photomultiplier eingesetzt. So können die Photonen zwischen 400 und 700 nm annähernd gleichwertig registriert werden.
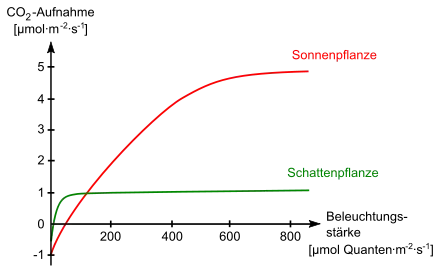
Wegen der direkten stöchiometrischen Beziehung zwischen absorbierten Photonen (im Bereich von 400 bis 700 nm) und der photosynthetischen CO2-Bindung wurde die Photonenstromdichte (engl. Photosynthetically Active Photon Flux Density, PPFD oder kurz PFD) in der Biologie zum Standard. Sie wird, im Gegensatz zum PAR, in Mikromol pro Quadratmeter pro Sekunde (µmol/(m²s)) gemessen. Ein Mol entspricht 6,022 · 1023 (Avogadro-Konstante) Photonen, ein µmol dementsprechend 6,022 · 1017 Photonen.
Durch Bewuchs absorbierte PAR
Dividiert man die APAR (die absorbierte PAR) durch die am Standort absorbierbare (messbare) PAR, ergibt sich die sogenannte FPAR (auch als „fPAR“ angegeben; fraction of PAR absorbed by canopy, dt. etwa ‚durch Bewuchs absorbierte PAR‘) die stark mit dem aus Satellitenbildern bestimmten NDVI („normierter differenzierter Vegetationsindex“) korreliert.
Per Satellit wird reflektierte PAR gemessen und mithilfe von Umrechnungsfaktoren die fPAR errechnet. Damit ist die Bestimmung des Zustands der Vegetation auch durch Fernerkundung möglich[21].
Anwendung in Pflanzenlampen
Eine Pflanzenlampe ist ein Leuchtmittel, das anstelle oder zusätzlich zu Sonnenlicht verwendet wird, um die von Licht induzierte Wirkung auf Pflanzen (Photosynthese und Photomorphogenese) zu verbessern.
Bei Indoor-Hydroponik-Anlagen oder Abbildungen von Growschränken sind oft Lampen mit violettem Licht zu sehen, diese emittieren nicht Licht mit 400 nm Wellenlänge, sondern eine additive Farbmischung mit starken Anteilen von blau und rot.
Aus PAR-Wirkspektren wurde ermittelt, welche spektrale Banden ein als Pflanzenlampe verwendetes Leuchtmittel haben sollte. Danach wurde auch die DIN 5031 Strahlungsphysik im optischen Bereich und Lichttechnik, Teil 10 „Photobiologisch wirksame Strahlung, Größen, Kurzzeichen und Wirkungsspektren“ ausgerichtet.
Photosynthetisch verfügbare Strahlung
Die Abkürzung PAR wird auch für Photosynthetically Available Radiation (übersetzt Photosynthetisch verfügbare Strahlung[22]) benutzt, jene Anteile der photosynthetisch aktiven Strahlung, die in bestimmten Wassertiefen oder Meerwasser-Wassertypen verfügbar sind[23][24]. Davon abgeleitet sind jene Anteile, die (von Algen) absorbiert werden, die Photosynthetically usable radiation (PUR) und davon wieder jene Anteile, die als chemische Energie gebunden werden, die Photosynthetically stored radiation (PSR)[25]
Literatur
- Sasa Fistric: Die Bestimmung der photosynthetisch aktiven Strahlung (PAR) für heterogene atmosphärische Bedingungen. Eine Methode zum Ableiten der globalen PAR für verschiedene tägliche Zweitintervalle und für die Tagessumme basierend auf Fernerkundungsdaten und Modellen. Dissertation, Wissenschaftszentrum Weihenstephan 2004.
- Helmut Mayer, Thomas Holst und Dirk Schindler: Mikroklima in Buchenbeständen Teil I: Photosynthetisch aktive Strahlung. In: Forstwissenschaftliches Centralblatt, Bd. 121, Heft 6, 2002, ISSN 0015-8003, S. 301–321, doi:10.1046/j.1439-0337.2002.02038.x.
Weblinks
- photosynthetisch aktive Strahlung im Fernerkundungslexikon
- Comparison of Quantum (PAR) Sensors with Different Spectral Sensitivities (Memento vom 8. Februar 2013 im Internet Archive) (PDF-Datei; 452 kB) LI-COR Biosciences, Technical Note 126
Einzelnachweise
- Kurve nach John Whitmarsh, Govindjee: The photossynthetic process; aus „Concepts in Photobiology: Photosynthesis and Photomorphogenesis“, Edited by GS Singhal, G Renger, SK Sopory, K-D Irrgang and Govindjee, Narosa Publishers/New Delhi; and Kluwer Academic/Dordrecht, Seiten 11–51. | G.S. Singhal: Concepts in Photobiology. Springer Science & Business Media, 2012, ISBN 978-94-011-4832-0 (eingeschränkte Vorschau in der Google-Buchsuche).
- Richard Pott: Spezielle Geobotanik. Springer-Verlag, 2008, ISBN 978-3-540-49357-0, S. 17 (eingeschränkte Vorschau in der Google-Buchsuche).
- Gerhard Richter: Stoffwechselphysiologie der Pflanzen. Georg Thieme Verlag, 1998, ISBN 978-3-13-442006-7, S. 106 (eingeschränkte Vorschau in der Google-Buchsuche).
- Sehlicht versus Wuchslicht. Teil IV: Bewertung des Lichts, PAR
- Gerhart Drews: Bakterien – ihre Entdeckung und Bedeutung für Natur und Mensch. Springer-Verlag, 2015, ISBN 978-3-662-45327-8, S. 120 (eingeschränkte Vorschau in der Google-Buchsuche).
- E. K. Gabrielsen: Lichtwellenlänge und Photosynthese. In: André Pirson (Hrsg.): Die CO2-Assimilation / The Assimilation of Carbon Dioxide: In 2 Teilen / 2 Parts (= Handbuch der Pflanzenphysiologie / Encyclopedia of Plant Physiology). Springer, Berlin, Heidelberg 1960, ISBN 978-3-642-94798-8, S. 1063–1092, doi:10.1007/978-3-642-94798-8_38.
- William H Hoover, Steinfort Earl Johnston, Frederick Sumner Brackett: Carbon dioxide assimilation in a higher plant. Washington 1933 (Faksimile in PDF-Datei).
- Valeriy Kharchenko: Handbook of Research on Renewable Energy and Electric Resources for Sustainable Rural Development. IGI Global, 2018, ISBN 978-1-5225-3868-4, S. 206 (eingeschränkte Vorschau in der Google-Buchsuche).
- K. J. McCree: The action spectrum, absorptance and quantum yield of photosynthesis in crop plants. In: Agricultural Meteorology. Band 9, 1972, S. 191–216, doi:10.1016/0002-1571(71)90022-7 (englisch).; PDF-Datei
- Katsumi Inada: Action spectra for photosynthesis in higher plants; Plant and Cell Physiology, Volume 17, Issue 2, 1 April 1976, S. 355–365, doi:10.1093/oxfordjournals.pcp.a075288
- Shinji Tazawa: Effects of Various Radiant Sources on Plant Growth. In: Japan Agricultural Research Quarterly. Ausgabe 33, 1999; zitiert nach Sehlicht versus Wuchslicht.Teil IV: Bewertung des Lichts, PAR.
- Bruce Bugbee: Toward an optimal spectral quality for plant growth and development: the importance of radiation capture, doi:10.17660/ActaHortic.2016.1134.1; Script (PDF-Datei) und Vortragsbilder (PDF-Datei)
- siehe seine Personendaten und die Publikationsliste auf seiner Website, gespeichert dort im Internet-Archiv
- „Figure 18. The relative quantum efficiency curve, also known as the McCree Curve, as determined by the average plant response for photosynthesis rate“; Michael Henke, Gerhard H. Buck-Sorlin: Using a Full Spectral Raytracer for Calculating Light Microclimate in Functional-Structural Plant Modelling; Computing and Informatics, Vol. 36, 2017, Seiten 1492–1522, doi:10.4149/cai 2017 6 1492; PDF-Datei
- Hans Mohr: Lehrbuch der Pflanzenphysiologie. Springer-Verlag, 1978, ISBN 978-3-642-96453-4, S. 311 (eingeschränkte Vorschau in der Google-Buchsuche).
- Peter Schopfer, Axel Brennicke: Pflanzenphysiologie. Springer-Verlag, 2016, ISBN 978-3-662-49880-4, S. 445 (eingeschränkte Vorschau in der Google-Buchsuche).
- Ichiro Terashima, Takashi Fujita, Takeshi Inoue, Wah bald Chow, Riichi Oguchi: „Green Light Drives Leaf Photosynthesis More Efficiently than Red Light in Strong White Light: Revisiting the Enigmatic Question of Why Leaves are Green?“; Physiologie der Pflanzen und Zellen, Band 50, Ausgabe 4, 1. April 2009, veröffentlicht: 25. Februar 2009, Seiten 684–697, doi:10.1093/pcp/pcp034
- H. H. Kim, G. D. Goins u. a.: Green-light supplementation for enhanced lettuce growth under red- and blue-light-emitting diodes. In: HortScience : a publication of the American Society for Horticultural Science. Band 39, Nummer 7, Dezember 2004, S. 1617–1622, PMID 15770792.
- S. W. Hogewoning, G. Trouwborst u. a.: Finding the optimal growth-light spectrum for greenhouse crops. In: Acta Horticulturae. 2012, S. 357, doi:10.17660/ActaHortic.2012.956.41.
- Redefining the McCree Curve at Utah State University – Fluence Bioengineering. In: fluence.science. 30. Mai 2018, abgerufen am 28. Oktober 2018 (englisch).
- Fraction of Photosynthetically Active Radiation
- Deutsche Gesellschaft für Polarforschung: Polarforschung. Deutsche Gesellschaft für Polarforschung, 1999 (eingeschränkte Vorschau in der Google-Buchsuche).
- Lars Olof Björn: Photobiology. Springer Science & Business Media, 2007, ISBN 978-0-387-72655-7, S. 131 (eingeschränkte Vorschau in der Google-Buchsuche).
- ScholarlyEditions: Issues in Global Environment: Freshwater and Marine Environments: 2011 Edition. ScholarlyEditions, 2012, ISBN 978-1-4649-6466-4 (eingeschränkte Vorschau in der Google-Buchsuche).
- Timothy R. Parsons: Biological Oceanographic Processes. Elsevier, 2013, ISBN 978-1-4832-8617-4, S. 67 (eingeschränkte Vorschau in der Google-Buchsuche).