Phellandrene
Die Phellandrene sind eine Gruppe chemischer Verbindungen, genauer von Monoterpen-Kohlenwasserstoffen. Es handelt sich um farblose, ölige Flüssigkeiten. Sie sind Bestandteil von ätherischen Ölen.
Vertreter
Die Strukturisomere α-Phellandren und β-Phellandren weisen je ein stereogenes Zentrum auf. Folglich gibt es je zwei Enantiomere des α-Phellandrens und des β-Phellandrens:
| Phellandrene | ||||||||
| Name | (R)-α-Phellandren | (S)-α-Phellandren | (R)-β-Phellandren | (S)-β-Phellandren | ||||
| Strukturformel | 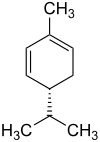 |
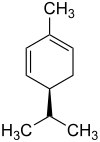 |
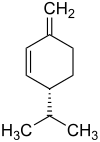 |
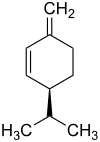 | ||||
| Andere Namen | (R)-2-Methyl-5-(1-methylethyl)-1,3-cyclohexadien | (S)-2-Methyl-5-(1-methylethyl)-1,3-cyclohexadien | (R)-3-Methylene-6-(1-methylethyl)cyclohexen | (S)-3-Methylene-6-(1-methylethyl)cyclohexen | ||||
| ISOPROPYLMETHYLCYCLOHEXANE (INCI)[1] | ||||||||
| CAS-Nummer | 4221-98-1 | 2243-33-6 | 6153-17-9 | 6153-16-8 | ||||
| 99-83-2 (RS)-α-Phellandren | 555-10-2 (RS)-β-Phellandren | |||||||
| 1329-99-3 (unspez.) | ||||||||
| EG-Nummer | 224-167-6 | |||||||
| 202-792-5 | 209-081-9 | |||||||
| 215-532-0 | ||||||||
| ECHA-Infocard | 100.021.971 | |||||||
| 100.002.538 | 100.008.257 | |||||||
| 100.014.121 | ||||||||
| PubChem | 442482 | 443160 | 443161 | 442484 | ||||
| 7460 | 11142 | |||||||
| Summenformel | C10H16 | |||||||
| Molare Masse | 136,24 g·mol−1 | |||||||
| Aggregatzustand | flüssig[2] | |||||||
| Kurzbeschreibung | farblose bis gelbliche Flüssigkeit[3] | |||||||
| Siedepunkt | 171–172 °C[2] | 171–172 °C[2] | ||||||
| Dichte | 0,84 bis 0,85 g·cm−3 (20 °C)[2] | |||||||
| Löslichkeit | nahezu unlöslich in Wasser, löslich in Ether[2] | |||||||
| Brechungsindex | 1,471 (25 °C)[4] | 1,4788 (20 °C)[4] | ||||||
| GHS- Kennzeichnung |
|
| ||||||
| H- und P-Sätze | 226‐315‐319‐334‐335 | siehe oben | ||||||
| keine EUH-Sätze | siehe oben | |||||||
| 261‐305+351+338‐342+311[5] | siehe oben | |||||||
Das 1:1-Gemisch aus (R)-α-Phellandren und (S)-α-Phellandren ist (RS)-α-Phellandren, ein Racemat. Analog ist (RS)-β-Phellandren ein Racemat aus (R)-β-Phellandren und (S)-β-Phellandren.
Vorkommen
α-Phellandren kommt unter anderem in Sternanis,[6] Dill (Anethum graveolens),[7] Arznei-Engelwurz (Angelica archangelica),[8] Canarium luzonicum,[9] Eukalyptus (Eucalyptus dives,[9] Eucalyptus globulus[8]) Lorbeer (Laurus nobilis),[8] Schwarzer Pfeffer (Piper nigrum),[8] Majoran (Origanum majorana),[8] Oregano (Origanum vulgare),[8] Muskatnuss (Myristica fragrans),[8] Thymian (Thymus vulgaris),[8] Kümmel (Carum carvi),[8] Kreuzkümmel (Cuminum cyminum),[8] Petersilie (Petroselinum crispum),[8] Fenchel (Foeniculum vulgare),[8] Ingwer (Zingiber officinale)[8] und Mutterkraut (Tanacetum parthenium)[8] vor.
β-Phellandren findet sich unter anderem in Sternanis,[6] Wacholder,[10] Dill (Anethum graveolens),[7] Arznei-Engelwurz (Angelica archangelica),[9] Eukalyptus (Eucalyptus dives,[9] Eucalyptus citriodora[11]) Kubeben-Pfeffer (Piper cubeba),[11] Kümmel (Carum carvi),[11] Fenchel ( Foeniculum vulgare),[11] Ingwer (Zingiber officinale)[11] Petersilie (Petroselinum crispum),[11] Zitronen ( Citrus limon),[11] Schwarzer Pfeffer (Piper nigrum),[11] Grünem Kardamom (Elettaria cardamomum),[11] Muskatnuss (Myristica fragrans),[11] Koriander (Coriandrum sativum),[11] Majoran (Origanum majorana),[11] und Wasserfenchel (Oenanthe aquatica)[11].
 Sternanis
Sternanis Dill
Dill Arznei-Engelwurz
Arznei-Engelwurz.jpg.webp) Eukalyptus
Eukalyptus Lorbeer
Lorbeer
Eigenschaften
Enantiomere Terpene besitzen in der Regel einen unterschiedlichen Geruch, weil die Geruchsrezeptoren des Menschen selbst chiral sind. α-Phellandren hat einen würzigen-minzartigen Geruch, β-Phellandren riecht minzartig, außerdem riechen beide nach Terpentin. Die Geruchsschwelle des β-Phellandrens liegt bei 700 ppb.
Die Phellandrene gehören durch die Kombination von Sechsring und konjugierten Doppelbindungen zu den Prohaptenen, d. h. ihre Oxidationsprodukte an der Luft bzw. Reaktionsprodukte im Kontakt mit der Haut sind allergieauslösend.[12]
Einzelnachweise
- Eintrag zu ISOPROPYLMETHYLCYCLOHEXANE in der CosIng-Datenbank der EU-Kommission, abgerufen am 16. September 2021.
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, ISBN 978-0-911910-00-1, S. 1243.
- Datenblatt α-Phellandren (PDF) bei Merck, abgerufen am 21. Januar 2019.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-420.
- Datenblatt α-Phellandrene bei Sigma-Aldrich, abgerufen am 5. Februar 2018 (PDF).
- Jayanta Kumar Patra, Gitishree Das, Sankhadip Bose, Sabyasachi Banerjee, Chethala N. Vishnuprasad, Maria Pilar Rodriguez‐Torres, Han‐Seung Shin: Star anise (Illicium verum): Chemical compounds, antiviral properties, and clinical relevance. In: Phytotherapy Research. Band 34, Nr. 6, Juni 2020, S. 1248–1267, doi:10.1002/ptr.6614.
- Birgit Faber, Kerstin Bangert, Armin Mosandl: GC-IRMS and enantioselective analysis in biochemical studies in dill (Anethum graveolens L.). In: Flavour and Fragrance Journal. Band 12, Nr. 5, September 1997, S. 305–309, doi:10.1002/(SICI)1099-1026(199709/10)12:5<305::AID-FFJ659>3.0.CO;2-7.
- ALPHA-PHELLANDRENE (engl., PDF) In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 18. August 2021.
- Karl‐Georg Fahlbusch, Franz‐Josef Hammerschmidt, Johannes Panten, Wilhelm Pickenhagen, Dietmar Schatkowski, Kurt Bauer, Dorothea Garbe, Horst Surburg: Flavors and Fragrances. In: Ullmann's Encyclopedia of Industrial Chemistry. Band 15, 2012, S. 73–198, doi:10.1002/14356007.a11_141.
- R. Hiltunen, I. Laakso: Gas chromatographic analysis and biogenetic relationships of monoterpene enantiomers in Scots Pine and juniper needle oils. In: Flavour and Fragrance Journal. Band 10, Nr. 3, Mai 1995, S. 203, doi:10.1002/ffj.2730100314.
- BETA-PHELLANDRENE (engl., PDF) In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 18. August 2021.
- M. A. Bergstrom et al.: Conjugated dienes as prohaptens in contact allergy: in vivo and in vitro studies of structure-activity relationships, sensitizing capacity, and metabolic activation. In: Chemical Research in Toxicology. Band 19, 2006, S. 760–769, PMID 16780354.


