Perameisensäure
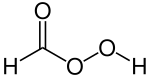
Perameisensäure ist eine organische Verbindung mit der Summenformel CH2O3. Es handelt sich um eine instabile, farblose Flüssigkeit, die durch Mischen von Ameisensäure mit Wasserstoffperoxid hergestellt werden kann. Aufgrund ihrer oxidierenden und desinfizierenden Eigenschaften wird sie in der chemischen, medizinischen und in der Lebensmittelindustrie verwendet.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Perameisensäure | |||||||||||||||
| Summenformel | CH2O3 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 62,02 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Eigenschaften
Perameisensäure ist eine farblose Flüssigkeit, die in Wasser, Alkoholen, Ethern, Benzol, Chloroform und anderen organischen Lösemitteln löslich ist.[3][4]
Verwendung
Ihre stark oxidierenden Eigenschaften werden sowohl verwendet, um Disulfidbrücken für die Proteinsequenzierung zu zerstören,[5] als auch zur Epoxidierung, Hydroxylierung und Oxidation in der organischen Synthese.[4]
In der medizinischen und der Lebensmittelindustrie wird Perameisensäure häufig verwendet um Arbeitsmittel zu desinfizieren. In dieser Funktion ist sie wirksam gegen Viren, bakterielle Sporen, Algen, mikroskopische Pilze, Mykobakterien und andere Mikroorganismen wie Zooplankton. Die Beliebtheit von Perameisensäure als Desinfektionsmittel begründet sich durch die Ungefährlichkeit ihrer Abbauprodukte, hauptsächlich Kohlendioxid, Sauerstoff und Wasser.[3][6] Die desinfizierende Wirkung der Perameisensäure ist außerdem schneller wirksam als die der verwandten Verbindungen Peressigsäure und Wasserstoffperoxid.[7] Die Hauptnachteile der Perameisensäure sind die Gefahren bei der Handhabung aufgrund der hohen Reaktivität und ihre Instabilität speziell beim Erhitzen, die dazu führt, dass die Säure innerhalb von 12 Stunden nach ihrer Synthese verwendet werden muss.[7][8][9]
Synthese
Perameisensäure kann durch die Reaktion von Ameisensäure mit Wasserstoffperoxid dargestellt werden, bei der folgende Gleichgewichtsreaktion stattfindet:

Über die Darstellung von reiner Perameisensäure wurde noch nicht berichtet, wässrige Lösungen mit Konzentrationen bis zu 48 % sind jedoch durch einfaches Mischen äquimolarer Lösungen der Reaktanten darstellbar.[3] Die Verwendung eines Überschusses eines der Reaktanten verschiebt das Gleichgewicht auf die Seite des Produktes. Die wässrige Lösung des Produktes kann destilliert werden, um eine Konzentration von etwa 90 % zu erreichen.[3]
Die Reaktion ist reversibel und kann für die großindustrielle Synthese verwendet werden, sofern sie durch einen Katalysator beschleunigt wird. Die Temperatur muss allerdings unter 80–85 °C gehalten werden, um eine mögliche Explosion zu vermeiden.[10] Als Katalysator können Salpetersäure, Flusssäure, Phosphorsäure, Schwefelsäure oder deren Salze zum Einsatz kommen.[3][11] Die Verwendung einer organischen Verbindung, die wenigstens eine Estergruppe enthält (z. B. Carbonsäureester),[12] oder Peressigsäure[7] ist ebenfalls möglich.
Gefahrenhinweise
Perameisensäure ist ungiftig; sie ruft Hautirritationen hervor, jedoch in geringerem Maße als Peressigsäure. Konzentrierte Säure über 50 % ist hochreaktiv; sie zersetzt sich schnell bei Erhitzen und neigt bei schnellem Erhitzen über 80–85 °C zum Explodieren. Sie kann sich bei Raumtemperatur entzünden oder explodieren, wenn sie mit brennbaren Stoffen wie Formaldehyd, Benzaldehyd, oder Anilin kombiniert wird, und explodiert bei Reaktion mit Metallpulvern.[3] Aus diesem Grund wird verschüttete Perameisensäure mit kaltem Wasser verdünnt und mit neutralen, nicht entflammbaren Bindemitteln aufgenommen, zum Beispiel mit Vermiculit.[4]
Einzelnachweise
- Perameisensäure - Lexikon der Chemie. (spektrum.de).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Daniel Swern: Organic Peracids. In: Chemical Reviews. Band 45, Nr. 1, 1949, S. 1–68, doi:10.1021/cr60140a001.
- Pradyot Patnaik: A comprehensive guide to the hazardous properties of chemical substances. 3. Auflage. John Wiley, Hoboken, NJ 2007, ISBN 978-0-471-71458-3, S. 128.
- Richard J. Simpson: Performic Acid Oxidation of Proteins. In: Cold Spring Harbor Protocols. Band 2007, Nr. 3, 2007, ISSN 1559-6095, S. pdb.prot4698, doi:10.1101/pdb.prot4698.
- R. Gehr, D. Chen, M. Moreau: Performic acid (PFA): tests on an advanced primary effluent show promising disinfection performance. In: Water Science and Technology. Band 59, Nr. 1, 2009, S. 89–96, doi:10.2166/wst.2009.761, PMID 19151490.
- Patent US6211237: Aqueous Disinfecting Agent Containing Performic Acid and Peracetic Acid Process for Production and Process for Use Thereof. Veröffentlicht am 3. April 2001, Erfinder: Preuss, A., Fuchs, R., Huss, M. & Schneider, R..
- O. Bydzovská, V. Měrka: Disinfecting properties of performic acid against bacteriophage phi X 174 as a model of small envelope--free viruses. In: Journal of Hygiene, Epidemiology, Microbiology, and Immunology. Band 25, Nr. 4, 1981, ISSN 0022-1732, S. 414–423, PMID 6459365.
- David H. Brown Ripin, Gerald A. Weisenburger, David J. am Ende, David R. Bill, Pamela J. Clifford, Clifford N. Meltz, James E. Phillips: Execution of a Performic Acid Oxidation on Multikilogram Scale. In: Organic Process Research & Development. Band 11, Nr. 4, 2007, S. 762–765, doi:10.1021/op700039r.
- Barbara Elvers, Fritz Ullmann: Ullmann's encyclopedia of industrial chemistry. 5. Auflage. Band 19. VCH, Weinheim [u. a.] 1991, ISBN 0-89573-169-X.
- James English, J. Delafield Gregory: Performic Acid Hydroxylation of α,β-Unsaturated Acids and Esters1. In: Journal of the American Chemical Society. Band 69, Nr. 9, 1947, S. 2120–2122, doi:10.1021/ja01201a016.
- Patent US6049002: Method for the preparation of aqueous solutions containing performic acid as well as their use. Veröffentlicht am 11. April 2000, Erfinder: Tapio Mattila, Reijo Aksela.