Pentafluorethan
Pentafluorethan ist eine gasförmige organisch-chemische Verbindung aus der Gruppe der fluorierten Kohlenwasserstoffe (FKW).
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
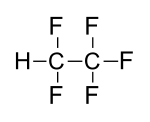 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Pentafluorethan | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C2HF5 | |||||||||||||||
| Kurzbeschreibung |
farbloses Gas mit schwach etherischem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 120,02 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt |
−103 °C[1] | |||||||||||||||
| Siedepunkt |
−48,1 °C [1] | |||||||||||||||
| Löslichkeit |
sehr schlecht in Wasser (430 mg·l−1 bei 25 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Treibhauspotential |
3691 (bezogen auf 100 Jahre)[3] | |||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−1100,4 kJ/mol[4] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Pentafluorethan kann durch Fluorierung von 2,2-Dichlor-1,1,1-trifluorethan mit Hilfe eines Katalysators gewonnen werden.
Eigenschaften
Pentafluorethan ist ein nicht brennbares Gas, welches schwerer ist als Luft und sich deshalb am Boden sammelt. Mit 0,43 g/l ist es nur geringfügig in Wasser löslich.[1] Die kritische Temperatur liegt bei 66,02 °C, der kritische Druck bei 36,20 bar und die kritische Dichte bei 4,7658 mol·l−1.[5]
Verwendung
Pentafluorethan findet als Lösch- und als Kältemittel Verwendung.
Umwelt
Pentafluorethan ist als Treibhausgas ca. 3700-mal stärker als CO2. Im Gegensatz zu den Fluorchlorkohlenwasserstoffen ist es aber nicht ozonschädigend. Im Kyoto-Protokoll ist es als „wasserstoffhaltiger Fluorkohlenwasserstoff“ benannt, dessen Emission reduziert werden muss.
Einzelnachweise
- Eintrag zu Pentafluorethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- D. Ripple, O. Matar: Viscosity of the saturated liquid phase of six halogenated compounds and three mixtures. In: J. Chem. Eng. Data. Band 38, 1993, S. 560–564, doi:10.1021/je00012a021.
- G. Myhre, D. Shindell et al.: Climate Change 2013: The Physical Science Basis. Working Group I contribution to the IPCC Fifth Assessment Report. Hrsg.: Intergovernmental Panel on Climate Change. 2013, Chapter 8: Anthropogenic and Natural Radiative Forcing, S. 24–39; Table 8.SM.16 (PDF).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-21.
- Y. Higashi: Critical parameters for HFC134a, HFC32 and HFC125. In: Int. J. Refrig. Band 17, 1994, S. 524–531.
