Oxathiolane
Oxathiolane bilden eine Stoffklasse im Bereich der Heterocyclen. Es sind 5-gliedrige Ringsysteme mit je genau einem Schwefel- und einem Sauerstoffheteroatom. Es gibt daher zwei Grundgerüste der Oxathiolane: das 1,2-Oxathiolan und das 1,3-Oxathiolan. Auch ionische Strukturen existieren. Die meisten Untersuchungen wurden über 1,3-Oxathiolan gemacht.

Unter dem Namen "Oxathiolane" werden nach der Hantzsch-Widman-Patterson-Nomenklatur die gesättigten Varianten bezeichnet. Unter Oxathiolen hingegen versteht man ungesättigte Derivate mit ansonsten gleicher Konstitution. Verbindungsklassen, die nach dieser Nomenklatur auch als Oxathiole/Oxathiolane gesehen werden können, sind die Sultine und Sultone.
Darstellung
1,3-Oxathiolan
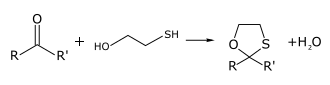
Eine Standardmethode für die Erzeugung von 1,3-Oxathiolanen ist die Kondensation von Mercaptoethanol mit Ketonen. Diese beruht auf der Betrachtung der 1,3-Oxathiolane als Monothioacetale. Um nennenswerte Ausbeuten zu erhalten, ist das Kondenswasser aus dem Gleichgewicht zu entfernen. Dies kann mit einem p-Toluolsulfonsäure/Benzol-Azeotrop bewerkstelligt werden; noch bessere Ausbeuten liefert bei den meisten Ketonen jedoch die Nutzung eines Überschusses an Bortrifluorid-Etherat.[1]
1,2-Oxathiolan
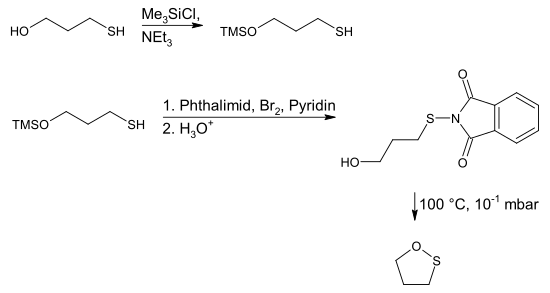
Die Knüpfung der Schwefel-Sauerstoff-Bindung im 1,2-Oxathiolan ist weniger trivial als der Ringschluss bei 1,3-Oxathiolan. Eine Möglichkeit hierzu ist die Pyrolyse des S-Phthalimids des 3-Mercapto-1-propanol. Hierzu muss der 3-Mercapto-1-propanol mit Trimethylsilylchlorid am Sauerstoffatom geschützt werden und kann dann mit einer stöchiometrischen Mischung aus Phthalimid, Brom und Pyridin zum N-(3-Hydroxypropylthio)phthalimid kondensiert werden.[2]
Eigenschaften
Eine interessante Eigenschaft des 1,2-Oxathiolans ist die Dekomposition zu Acrolein bei 400–450 K unter Abspaltung von Schwefelwasserstoff.[3]
Literatur
- J. Alvarez-Builla, J. J. Vaquero, J. Barluenga: Modern Heterocyclic Chemistry. Band 2, Wiley-VCH Verlag & Co.KGaA, 2011, ISBN 978-3-527-33201-4, S. 966–980.
- D. L. Rakhmanklov, V. V. Zorin, F. N. Latypova, S. S. Zlotski, R. A. Karakhanov: In: Russian Chemical Reviews. Band 52, 1983, S. 350.
- P. Wimmer: Methoden der organischen Chemie. Houben-Weyl, 1991.
Weblinks
Einzelnachweise
- G. Edwin Wilson, Jr., M. G. Huang, W. W. Schloman, Jr.: Facile Synthesis of 1,3-Oxathiolanes from Ketones and 2-Mercaptoethanol. In: The Journal of Organic Chemistry. Band 33, Nr. 5, 9. Oktober 1967, S. 2133–2134, doi:10.1021/jo01269a103.
- Anthony P. Davis und Gordon H. Whitham: 1,2-Oxathiolan, a Simple Sultene. In: Journal of the Chemical Society, Chemical Communication. 1981, S. 741, f., doi:10.1039/C39810000741.
- Lars Carlsen und Helge Egsgaard: Thermal Decomposition of 1,2-Oxathiolane in the Gas Phase. In: Chemische Berichte. Band 117, Nr. 4, 1984, S. 1393–1399, doi:10.1002/cber.19841170411.