Organoid
Ein Organoid (von griechisch ὄργανον órganon: Organ, Werkzeug und εἶδος eidos: Art, Form, Gestalt) ist eine wenige Millimeter große, organähnliche Mikrostruktur, die mit Methoden der Zellkultur artifiziell erzeugt werden kann. Unter geeigneten Kulturbedingungen können Organoide aus einer oder wenigen Gewebezellen, embryonalen Stammzellen oder induzierten pluripotenten Stammzellen gezüchtet werden. Sofern keine mesenchymalen Stammzellen verwendet wurden,[1] besitzen Organoide kein Stroma und keinerlei Gefäße; sie zeigen dennoch physiologisch relevante, organähnliche Eigenschaften.
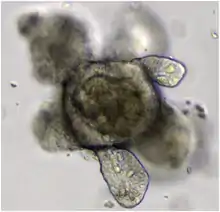
Voraussetzungen
Zur Erzeugung von Organoiden bedarf es als Ausgangsmaterial pluripotenter Stammzellen. Solche Zellen befinden sich in einem Zustand, aus dem heraus sie fähig sind, sich zu differenzieren und sich gemeinsam zu strukturieren. Ergebnis der Selbstorganisation sind gewebeartige Verbände aus ausdifferenzierten Zellen, die sich in Gestalt und Funktion unterscheiden. Die Struktur von Organoiden gleicht zumindest teilweise menschlichen oder tierischen Organen.
Organoide entstehen meist nicht auf einer Agarschicht; sie brauchen flüssiges Nährmedium, das die Möglichkeit bietet, räumlich in einer 3D-Zellkultur zu wachsen. Die Herstellung von Organoiden erfordert ein steriles Zellkulturlabor, um die anspruchsvolle, konstruktive Gewebezüchtung durchzuführen. In diesem Arbeits- und Forschungsfeld der Biotechnologie werden eventuell auch gentechnische Verfahren eingesetzt, vorzüglich die CRISPR/Cas-Methode.
Die Produktpalette umfasst winzige Modelle innerer Organe (Herz, Magen, Darm, Niere). Erstaunliche Fortschritte gelangen bei den komplexen Strukturen des Gehirns. Solche zerebrale Organoide modellieren Großhirnrinde, Hippokampus, Mittelhirn, Hypothalamus, Kleinhirn, vordere Hypophyse und Augennetzhaut des Menschen, von Säugern, seltener von anderen Wirbeltieren.[2] Für ihre Anzucht gibt es Protokolle, welche die Entwicklung von Regionen des Gehirns bewirken.[3]
Zerebrale Organoide
Großhirn-Modelle
Für komplexe Strukturen ist es erforderlich, Teilergebnisse zusammenzuführen. Aus dorsalen und ventralen Organoiden des Großhirns entstand ein Verbund mit dorsoventraler Achse. Fluoreszierende Reportermoleküle stellten Interneurone dar, die von der ventralen zur dorsalen Großhirn-Einheit wanderten.[4]
Kleinhirn-Modelle
Der Kultur menschlicher embryonaler Stammzellen wurden nach und nach Wachstumsfaktoren angeboten. In Selbstorganisation entstanden Zellverbände, die dem embryonalen Neuralrohr glichen. Sie besaßen dorsoventrale Polarität und Vorne-hinten-Ausrichtung. Die Schichtstrukturen wiederholten die Entstehung des Kleinhirns. Und die induzierten Purkinjezellen zeigten spezifisch menschliche Merkmale.[5]
Weitere Organoide
Herz-Modelle
Zweidimensionale Kolonien induzierter pluripotenter Stammzellen des Menschen (hiPSC) wurden in dreidimensionale Kulturen überführt. So entstanden, wiederum in Selbstorganisation, winzige Herzkammern. Video eines schlagenden Herzkammer-Organoids zeigt der folgende Link.[6]
Magen-Modelle
Menschliche Magen-Organoide wurden in vitro schrittweise hergestellt, indem man die räumlichen und zeitlichen Zellsignale der natürlichen Magenentwicklung nachahmte. Als Vorbilder dienten Studien an Darm- und Lungen-Geweben. Die Magen-Modelle eignen sich, das Zusammenwirken von Zellen zu studieren, die nicht einem Epithel-Typ angehören, sondern endothelial, neuronal oder mesenchymal sind. Zweck derartiger Studien sei genetischer Modellbau, das Prüfen von Arzneimitteln und künftig die Transplantation.[7]
Darm-Modelle
Das Darmepithel (die oberste Zellschicht des Darms, die die Grenzschicht und Barriere zum Darmlumen mit der Mikrobiota bildet) erneuert sich zeitlebens, ausgehend von sich aktiv teilenden Stammzellen. Diese befinden sich auf dem Grund der Krypten (Einstülpungen der Epithelschicht, die im Dünndarm durch Ausstülpungen (Villi) ergänzt werden). Diese Stammzellen (Lgr5-positive Zellen) erneuern das komplette Darmepithel in ca. 3–5 Tagen unter physiologischen Bedingungen[8]. Aufgrund dieser Besonderheit waren intestinale Organoide, die durch die Kultivierung von Krypten gewonnen wurden, unter den ersten Organoid-Modellen[9]. Außerdem können Darmorganoide auch durch Differenzierung von pluripotenten Stammzellen mit spezifischen Wachstumsfaktoren generiert werden.[10] Darmorganoide eignen sich zur Erforschung von Nährstoff- und Medikamententransportprozessen[11] sowie zur Untersuchung der Hormonausschüttung von Enteroendokrinen Zellen[12]. Außerdem können Darmorganoide auch für infektionsbiologische Studien mit verschiedenen Enterobakterien und Parasiten verwendet werden.[13][14][15][16] Um Organoidmodelle dem Darm eines Menschen oder Tiers noch ähnlicher zu machen, können Darmorganoide auch zusammen mit Immunzellen kultiviert werden.[17]
Nieren-Modelle
Nach einem Nephron-Protokoll ließen sich Vorläuferzellen für Untereinheiten der menschlichen Niere ausdifferenzieren. Mit geeigneten Biomarkern wies man Podozyten, proximale Nierenkanälchen, Henle-Schleifen und distale Kanälchen nach. Die Strukturfolge war einem Nephron in vivo gleichwertig.[18] Ein Übersichtsartikel berichtet vom Funktionsnachweis an proximalen Nierenkanälchen, die Dextran durch Endozytose aufnahmen. Angeborene Nierenkrankheiten wären mit solchen Organoiden zu simulieren, in deren humane pluripotente Stammzellen krankmachende Mutationen mittels CRISPR eingeschleust wurden. Auf diese Weise sei (unbekannten) Genen auf die Spur zu kommen, die Nierenkrankheiten verursachen.[19]
Forschungsziele
- Prüfung von Arzneimitteln, wodurch die Anzahl von Tierversuchen reduziert werden kann.
- Die Genkaskaden für Differenzierung und Selbstorganisation darstellen.
- Genmutationen ermitteln, die Gestaltfehler der Organe oder deren Funktionsstörungen verantworten.
- Organspenden und Zellspenden entwickeln, die durch Induktion von Stammzellen aus dem Körper des Patienten gewonnen werden. Solche Stammzelltherapien ersetzen passgenau kranke Zellen durch gesunde; sie sind eine Hoffnung der personalisierten Medizin.
Literatur
- Madeline A Lancaster, Jürgen A Knoblich: Organogenesis in a dish: modeling development and disease using organoid technologies. In: Science, 345 (6194), 2014, S. 1247125. doi:10.1126/science.1247125. → Pluripotente Stammzellen können im Prinzip alle Zelltypen hervorbringen. Diese Fähigkeit wird genutzt, um die Entwicklung von Organen oder deren Krankheiten zu modellieren.
- Jürgen A Knoblich: Minigehirne aus dem Labor. In: Spektrum der Wissenschaft. 12/2017, S. 30–37.
- Ulrich Bahnsen: Hier wachsen Gehirne. In: Die Zeit, Nr. 17/2018, S. 35–36.
- A Lavazza, M Massimini: Cerebral organoids: ethical issues and consciousness assessment. In: J Med Ethics, Februar 2018. doi:10.1136/medethics-2017-104555; in Druck.
Einzelnachweise
- Gretel Nusspaumer, Sumit Jaiswal, Andrea Barbero, Robert Reinhardt, Dana Ishay Ronen, Alexander Haumer, Thomas Lufkin, Ivan Martin, Rolf Zeller: Ontogenic identification and analysis of mesenchymal stromal cell populations during mouse limb and long bone development. In: Stem Cell Reports, 9, 2017, S. 1124–1138.
- Elizabeth Di Lullo, Arnold R Kriegstein: The use of brain organoids to investigate neural development and disease. In: Nat Rev Neurosci 18 (10), 2017, S. 573–584, PMC 5667942 (freier Volltext).
- Joshua A Bagley, Daniel Reumann, Juergen A Knoblich: Detailed cerebral organoid fusion method. In: Protocol Exchange, 2017, doi:10.1038/protex.2017.064.
- Joshua A Bagley, Daniel Reumann, Shan Bian, Julie Lévi-Strauss, Juergen A Knoblich: Fused dorsal-ventral cerebral organoids model complex interactions between diverse brain regions. In: Nature Methods, 14 (7), 2017, S. 743–751, PMC 5540177 (freier Volltext).
- Keiko Muguruma, Ayaka Nishiyama, Hideshi Kawakami, Kouichi Hashimoto, Yazici Sasai: Self-organization of polarized cerebellar tissue in 3D culture of human pluripotent stem cells. In: Cell Rep 10 (4), 2015, S. 537–550. cell.com (PDF).
- Plansky Hoang, Jason Wang, Bruce R Conklin, Kevin E Healy, Zhen Ma: Generation of spatial-patterned early-developing cardiac organoids using human pluripotent stem cells. In: Nature Protocols, 13 (4), 2018, S. 723–737. Am Link-Ende: Video eines schlagenden Herzkammer-Modells, 600 μm Durchmesser.
- Alexandra K Eicher, H Matthew Berns, James M Wells: Translating developmental principles to generate human gastric organoids. In: Cell Mol Gastroenterol Hepatol, 5 (3), 2018, S. 353–363, PMC 5852324 (freier Volltext).
- Barker, N., van Es, J., Kuipers, J. et al. Identification of stem cells in small intestine and colon by marker gene Lgr5. Nature 449, 1003–1007 (2007). https://doi.org/10.1038/nature06196
- Sato, T., Vries, R., Snippert, H. et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature 459, 262–265 (2009). https://doi.org/10.1038/nature07935
- Shizuka Miura, Atsushi Suzuki: Brief summary of the current protocols for generating intestinal organoids. In: Development, Growth & Differentiation. Band 60, Nr. 6, August 2018, ISSN 0012-1592, S. 387–392, doi:10.1111/dgd.12559 (wiley.com [abgerufen am 7. September 2021]).
- Tamara Zietek, Pieter Giesbertz, Maren Ewers, Florian Reichart, Michael Weinmüller: Organoids to Study Intestinal Nutrient Transport, Drug Uptake and Metabolism – Update to the Human Model and Expansion of Applications. In: Frontiers in Bioengineering and Biotechnology. Band 8, 2020, ISSN 2296-4185, doi:10.3389/fbioe.2020.577656 (frontiersin.org [abgerufen am 13. September 2020]).
- Tamara Zietek, Eva Rath, Dirk Haller, Hannelore Daniel: Intestinal organoids for assessing nutrient transport, sensing and incretin secretion. In: Scientific Reports. Band 5, Nr. 1, 19. November 2015, ISSN 2045-2322, S. 16831, doi:10.1038/srep16831 (nature.com [abgerufen am 13. September 2020]).
- Petra Geiser, Maria Letizia Di Martino, Pilar Samperio Ventayol, Jens Eriksson, Eduardo Sima: Salmonella enterica Serovar Typhimurium Exploits Cycling through Epithelial Cells To Colonize Human and Murine Enteroids. In: mBio. Band 12, Nr. 1, 23. Februar 2021, ISSN 2161-2129, doi:10.1128/mBio.02684-20, PMID 33436434, PMC 7844539 (freier Volltext) – (asm.org [abgerufen am 7. September 2021]).
- Benjamin J. Koestler, Cara M. Ward, C. R. Fisher, Anubama Rajan, Anthony W. Maresso: Human Intestinal Enteroids as a Model System of Shigella Pathogenesis. In: Infection and Immunity. Band 87, Nr. 4, April 2019, ISSN 0019-9567, doi:10.1128/IAI.00733-18, PMID 30642906, PMC 6434139 (freier Volltext) – (asm.org [abgerufen am 7. September 2021]).
- Sridevi Ranganathan, Michele Doucet, Christen L. Grassel, BreOnna Delaine-Elias, Nicholas C. Zachos: Evaluating Shigella flexneri Pathogenesis in the Human Enteroid Model. In: Infection and Immunity. Band 87, Nr. 4, April 2019, ISSN 0019-9567, doi:10.1128/IAI.00740-18, PMID 30642900, PMC 6434113 (freier Volltext) – (asm.org [abgerufen am 7. September 2021]).
- Devanjali Dutta, Inha Heo, Roberta O'Connor: Studying Cryptosporidium Infection in 3D Tissue-derived Human Organoid Culture Systems by Microinjection. In: Journal of Visualized Experiments. Nr. 151, 14. September 2019, ISSN 1940-087X, S. 59610, doi:10.3791/59610 (jove.com [abgerufen am 7. September 2021]).
- Gaelle Noel, Nicholas W. Baetz, Janet F. Staab, Mark Donowitz, Olga Kovbasnjuk: A primary human macrophage-enteroid co-culture model to investigate mucosal gut physiology and host-pathogen interactions. In: Scientific Reports. Band 7, Nr. 1, 31. Mai 2017, ISSN 2045-2322, S. 45270, doi:10.1038/srep45270, PMID 28345602, PMC 5366908 (freier Volltext) – (nature.com [abgerufen am 7. September 2021]).
- Ryuji Morizane, Albert Q Lam, Benjamin S Freedman, Seiji Kishi, M Todd Valerius, Joseph V Bonventre: Nephron organoids derived from human pluripotent stem cells model kidney development and injury. In: Nat Biotechnol, 33 (11), 2015, S. 1193–1200, PMC 4747858 (freier Volltext).
- Elena Garreta, Nuria Montserrat, Juan Carlos Izpisua Belmonte: Kidney organoids for disease modeling. In: Oncotarget 9 (16), 2018, S. 12552–12553.