Induzierte pluripotente Stammzelle
Induzierte pluripotente Stammzellen (iPS-Zellen) sind pluripotente Stammzellen, die durch künstliche Reprogrammierung von nicht-pluripotenten somatischen Zellen entstanden sind. Die Umwandlung wird durch von außen angeregte Expression spezieller Gene (Transkriptionsfaktoren) in der Körperzelle angestoßen, für die verschiedene Techniken existieren. iPS-Zellen ähneln natürlichen Stammzellen in vielen Eigenschaften stark, ob die heutigen iPS-Zellen in allen Eigenschaften mit natürlichen Stammzellen übereinstimmen, ist eine ungeklärte Frage. Induzierte pluripotente Stammzellen haben ein hohes medizinisches Potential, da die Forschung an ihnen weniger ethische Probleme mit sich zieht als die an Embryonalen Stammzellen. Außerdem lassen sich speziell auf Patienten angepasste iPS-Zellen erzeugen.
Nachdem 2006 im Labor des japanischen Stammzellenforschers Shin’ya Yamanaka die ersten iPS-Zellen hergestellt wurden, ist die Forschung an iPS-Zellen heute eines der sich am schnellsten weiterentwickelnden Gebiete der Biologie. Für die Entwicklung induzierter pluripotenter Stammzellen erhielt Shin’ya Yamanaka 2012 den Nobelpreis für Physiologie oder Medizin.[1]
Herstellung von iPS-Zellen
Entdeckung
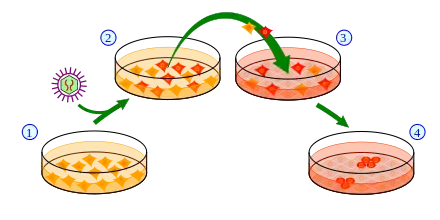
1) Bilden einer Zellkultur von somatischen Zellen
2) Einbringen der Pluripotenzgene in die Zellen durch einen Retrovirus-Vektor. Zellen, die die exogenen Gene exprimieren sind rot eingezeichnet
3) Ernten und Kultivieren der Zellen unter Verwendung von Fütterzellen (grau)
4) Ein kleiner Teil der Zellen (rot) wird zu iPS-Zellen.
Sowohl Embryonale Stammzellen (ES-Zellen), die mit Körperzellen fusioniert wurden, als auch die Zellen der ersten Zellteilungen nach einem somatischen Zellkerntransfer sind in der Lage, Körperzellen zu einem pluripotenten Zustand umzuprogrammieren. Außerdem war es vor 2006 in mehreren Experimenten gelungen, durch Überexpression bzw. Unterexpression von einzelnen Transkriptionsfaktoren den Zelltyp von somatischen Zellen zu ändern (Transdifferenzierung).[2][3] Shin’ya Yamanaka stellte auf diesen Grundlagen aufbauend die Hypothese auf, dass Gene, die in ES-Zellen eine besonders wichtige Rolle spielen, auch in der Lage sein könnten, eine Körperzelle in einen pluripotenten Zustand zurückzuversetzen. Zusammen mit Kazutoshi Takahashi führte er Experimente an Fibroblasten des Modellorganismus Maus durch, in denen die Expression von zentralen Transkriptionsfaktoren in Körperzellen dadurch angeregt wurde, dass deren DNA durch ein Retrovirus in das Genom eingebracht wurde (Transduktion).
Ausgehend von insgesamt 24 Kandidaten-Genen konnte er im Experiment zeigen, dass mit einer Kombination aus den vier Genen c-Myc, Klf-4, Oct-4 und Sox-2 die Reprogrammierung einiger Zellen in einen pluripotenten Zustand möglich ist.[4] Überraschend war für ihn hierbei, dass das Nanog-Gen, das zur Selbsterneuerung von Stammzellen essentiell ist, nicht benötigt wurde. Die Zellen ähnelten natürlichen Stammzellen stark, waren jedoch nicht in der Lage, nach der Injektion in die Blastozyste eines Maus-Embryo eine lebende Chimäre zu erzeugen. Dies gelang Yamanakas Team Mitte 2007, zeitgleich mit zwei anderen Laboren.[5][6][7] Die entscheidende Verbesserung in dieser zweiten Generation von iPS-Zellen war, dass zum Erhalt der erfolgreich umgewandelten Zellen nicht Fbx15, sondern Nanog verwendet wurde (der Anteil der erfolgreich reprogrammierten Zellen einer Zellkultur ist sehr gering, er liegt im Promille- bzw. unteren Prozentbereich). Induzierte pluripotente Stammzellen besitzen einen teilweise unterschiedlichen Phänotyp zu embryonalen Stammzellen.[8] Die Umwandlung zu induzierten pluripotenten Stammzellen ist unter anderem von einer Entfernung der Trimethylierung des Lysins im Histon H3 an Position 27 (H3K27me3) begleitet.[9]
Menschliche iPS-Zellen
Ende 2007 gelang es unabhängig voneinander mehreren Teams, iPS-Zellen aus menschlichen Körperzellen zu erzeugen.[10][11][12] Diese Studien zeigten auch, dass sich aus menschlichen iPS-Zellen Zellen aller drei Keimblätter gewinnen lassen.
Das Experiment von Yu aus dem Labor James Thomsons hatte die Besonderheit, dass statt der vier Pluripotenzgene Yamanakas eine andere Kombination von Genen aktiviert wurden: Neben Oct4 und Sox-2 waren dies Nanog und Lin-28. Dies zeigte, dass es möglich ist, auf c-Myc verzichten zu können. c-Myc ist ein bekanntes Protoonkogen.
Verbesserungen der Methode
Nach der erfolgreichen Reprogrammierung von Fibroblasten wurde gezeigt, dass sich Zellen aus unterschiedlichem Gewebe (Blut, Leber, Gehirn, Pankreas u. a.) zur Pluripotenz umprogrammieren lassen.[13] Eine große Hürde auf dem Weg zur klinischen Anwendung von iPS-Zellen besteht jedoch darin, dass bei der Transduktion durch Retroviren das Genom der Empfängerzelle verändert wird, was Krebs zur Folge haben kann. Ein weiteres Risiko ist das Protoonkogen c-Myc, das – obwohl nicht unentbehrlich – die Effizienz der Methode stark verbessert.
Aus diesem Grund wurde bald nach Methoden gesucht, die das Genom der Empfängerzelle nicht dauerhaft verändern und so gentechnisch veränderte Organismen zu vermeiden. Ein Ansatz besteht darin, Adenoviren als Vektor zu verwenden statt Retroviren.[14] Ein anderer Ansatz besteht darin die Gene in Form eines Plasmids in die Zelle zu bringen, so dass die Chromosomen der Zelle nicht verändert werden.[15] Schließlich gelang es Forschern 2009 sogenannte protein-induzierte pluripotente Stammzellen (piPS-Zellen) durch das Einbringen von rekombinanten Proteinen zu erzeugen. Bei dieser Methode produziert die Zelle die notwendigen Proteine nicht selbst durch Translation wie bei allen vorherigen Ansätzen. Stattdessen werden sie – in leicht veränderter Form, damit sie die Zellmembran passieren können – der Zelle von außen zugeführt.[16] Die meisten dieser alternativen Methoden erreichen jedoch eine weitaus niedrigere Effizienz, als die stabile Transfektion durch die ursprünglichen vier Pluripotenzgene.
Die Erzeugung induzierter pluripotenter Stammzellen wurde von der Zeitschrift Nature Methods zur Methode des Jahres 2009 gekürt.[17]
Nachweismethoden
Zum Nachweis, dass die reprogrammierten Zellen wirklich pluripotente Stammzellen sind, ist eine Reihe von Verfahren notwendig. Man kann zwischen morphologischen, molekularen und funktionellen Nachweismöglichkeiten unterscheiden.[18]
- Morphologisch: Hierbei werden potentielle iPS-Zellen unter dem Mikroskop mit natürlichen ES-Zellen verglichen. Kriterien sind dabei unter anderem die Form der Zellen oder die Zeit zwischen zwei Zellteilungen
- Molekular: Hier werden die Muster der Transkription sowie das epigenetische Methylierungsmuster von Promotorregionen spezieller Gene zwischen iPS-Zellen und ES-Zellen verglichen.
- Funktionell: Die Eigenschaft der Pluripotenz wird dadurch nachgewiesen, dass iPS-Zellen in immundefekte Mäuse injiziert werden. Diese bilden spontan Teratome aus, welche Zellen aus allen drei Keimblättern enthalten und somit die Pluripotenz der ursprünglichen Zellen belegen. In einem weiteren wichtigen Test werden iPS-Zellen in Maus-Blastozysten injiziert. Aus funktionellen iPS-Zellen entwickeln sich so lebensfähige Chimären. Da es aus ethischen Gründen nicht in Frage kommt, menschliche Chimären zu erzeugen, ist es schwierig, die Tendenz zur Tumorbildung von menschlichen iPS-Zellen zu testen.
iPS Zellen können aber auch mit tetraploiden Blastozysten kombiniert werden. Hierbei können die Blastozysten lediglich Plazentagewebe ausbilden und der Embryo muss aus den iPS-Zellen herstammen. Dieser strengere Test konnte nun mit iPS-Zellen aus Mäusen erfolgreich durchgeführt werden.[19]
Mechanismus
Der genaue Mechanismus des zur Pluripotenz führenden Prozesses ist weitgehend unverstanden. Wegen der geringen Effizienz der Methode ist es schwierig, Zellen gezielt während des graduellen, etwa zehntägigen Prozesses der Reprogrammierung zu verfolgen.[20] Bei den ersten Generationen von iPS-Zellen lag die Erfolgsrate nur bei 0,05 %. Diese Prozentzahl liegt in der gleichen Größenordnung wie der Anteil natürlich vorkommender Stammzellen in einer Population von Hautzellen, so dass die Hypothese aufkam, dass nicht terminal ausdifferenzierte Zellen, sondern seltene natürliche Stammzellen zu iPS-Zellen werden.[21]
In den folgenden Jahren konnte dieser Verdacht entkräftet und gezeigt werden, dass vollständig ausdifferenzierte Zellen fähig sind, zu iPS-Zellen zu werden.[22] Außerdem wurde die Effizienz der auf Retroviren basierenden Methode durch die zusätzliche Zugabe von bestimmten Chemikalien drastisch auf ca. 10 % erhöht.[23] Trotzdem ist es möglich, dass weniger weit ausdifferenzierte Zellen sich leichter reprogrammieren lassen.
Heute vermuten die meisten Forscher, dass der Prozess der Reprogrammierung stochastischer Natur ist, bei dem verschiedene „Barrieren“ epigenetischer Art überwunden werden müssen. Zum einen müssen die Promotorregionen derjenigen Gene, die für die Pluripotenz essentiell sind, demethyliert werden. Auch die Acetylierung der Histone muss während der Reprogrammierung geändert werden. Man geht davon aus, dass diese Prozesse stochastischer Natur sind, und dass ein Teil der ursprünglichen Zellen auf dem Weg zur Pluripotenz in Zwischenzuständen hängenbleiben (wie etwa die ursprüngliche Generation der iPS-Zellen von Yamanaka, die keine lebenden Chimären erzeugen konnte). Es spricht einiges dafür, dass prinzipiell alle Zellen zu iPS-Zellen reprogrammiert werden können, auch wenn die Zeit, in der dies geschieht, stark von Zelle zu Zelle variiert.[24]
Potentielle medizinische Anwendungen
Für die medizinische Forschung sind iPS-Zellen interessant, weil sich mit ihrer Hilfe patientenspezifische Zellen herstellen lassen. Hierdurch kann möglicherweise in Zukunft das Problem der Immunabstoßung, das herkömmliche Stammzelltherapien (Stammzelltransplantation) haben, umgangen werden.
Es ist Forschern bereits gelungen, iPS-Zellen von Patienten mit Krankheiten wie Amyotropher Lateralsklerose[25] oder Spinaler Muskelatrophie[26] zu isolieren und diese zu Neuronen differenzieren zu lassen. Da man diese Zellen oft nur schwer auf natürlichem Wege erhalten kann, kann dieses Verfahren das Studium von Krankheiten im Labor verbessern.
Bei Mäusen ist es gelungen, mittels Transplantation von iPS-Zellen Sichelzellenanämie zu therapieren[27] und die Symptome der Parkinson-Krankheit zu lindern.[28] Diese Methoden haben zur Zeit jedoch noch erhebliche Risiken (Bildung von Teratomen und anderen Tumoren), so dass eine klinische Anwendung mit dem derzeitigen Stand der Technologie noch nicht in Frage kommt.
Nach Einschätzung führender Forscher auf dem Gebiet liegt die therapeutische Anwendung von iPS-Zellen daher noch in der Ferne.[29][30] Eine Verwendung zum Studium von Krankheiten und zum Testen potentieller Medikamente im Labor könnte jedoch nach Einschätzung Yamanakas schon in wenigen Jahren weite Verbreitung finden.[31]
Ethische Gesichtspunkte und kritische Stimmen
Da iPS-Zellen aus Körperzellen entstehen, treten bei ihrer Herstellung im Vergleich zu embryonalen Stammzellen weit weniger ethische Probleme auf, Therapeutisches Klonen oder In-vitro-Fertilisation sind nicht notwendig. Zum Identitätsnachweis sind natürliche ES-Zellen aber gegenwärtig auch bei der Forschung an iPS-Zellen unverzichtbar. Aber auch die Forschung an iPS-Zellen selbst ist nicht frei von ethischen Problemen. Begünstigt durch den relativ einfachen Prozess der Herstellung ist es denkbar, dass in Zukunft aus iPS-Zellen Gameten gewonnen werden können oder mit ihrer Hilfe menschliche Klone erzeugt werden könnten, was beides ethische Probleme aufwirft.[32]
Der extrem schnelle Fortschritt der Forschung im Gebiet der iPS-Zellen, verbunden mit starker Resonanz der Öffentlichkeit und Medien und großen Hoffnungen auf zukünftige neue Therapieformen, stößt auch auf kritische Stimmen. Gerade auch von den Forschern selbst wurden Bedenken geäußert, dass die starke Konkurrenz und der wettlaufartige Charakter auf dem Gebiet der Forschung schaden könnte und dazu führe, dass vorschnell veröffentlicht wird und zu wenig Identitätstests und Langzeituntersuchungen auf Tumorbildung durchgeführt werden.[33][34]
2014 führte ein Skandal um zwei experimentelle Veröffentlichungen in Nature zu STAP-Zellen, einer Untermenge von iPS-Zellen, die nach Angabe der Autoren schon durch äußere Stimuli Pluripotenz erlangt haben sollten, zu einem Rückzug der Artikel, da sich die Ergebnisse als fabriziert herausstellten.[35]
Literatur
- K. Hochedlinger, K. Plath: Epigenetic reprogramming and induced pluripotency. In: Development. Band 136, Nummer 4, Februar 2009, S. 509–523, ISSN 0950-1991. doi:10.1242/dev.020867. PMID 19168672. PMC 2685952 (freier Volltext). (Review).
- M. Baker: Stem cells: Fast and furious. In: Nature. Band 458, Nummer 7241, April 2009, S. 962–965, ISSN 1476-4687. doi:10.1038/458962a. PMID 19396119.
Einzelnachweise
- Pressemeldung zum Nobelpreis für Medizin 2012, The Nobel Assembly at Karolinska Institutet, 8. Oktober 2012, abgerufen am 8. Oktober 2012
- S. Yamanaka, H. M. Blau: Nuclear reprogramming to a pluripotent state by three approaches. In: Nature (2010), Bd. 465(7299), S. 704–712. PMID 20535199; PMC 2901154 (freier Volltext).
- nach Hochedlinger, Plath (2009)
- K. Takahashi, S. Yamanaka: Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. In: Cell. Band 126, Nummer 4, August 2006, S. 663–676, ISSN 0092-8674. doi:10.1016/j.cell.2006.07.024. PMID 16904174.
- K. Okita, T. Ichisaka, S. Yamanaka: Generation of germline-competent induced pluripotent stem cells. In: Nature. Band 448, Nummer 7151, Juli 2007, S. 313–317, ISSN 1476-4687. doi:10.1038/nature05934. PMID 17554338.
- N. Maherali, R. Sridharan u. a.: Directly reprogrammed fibroblasts show global epigenetic remodeling and widespread tissue contribution. In: Cell stem cell. Band 1, Nummer 1, Juni 2007, S. 55–70, ISSN 1875-9777. doi:10.1016/j.stem.2007.05.014. PMID 18371336.
- M. Wernig, A. Meissner u. a.: In vitro reprogramming of fibroblasts into a pluripotent ES-cell-like state. In: Nature. Band 448, Nummer 7151, Juli 2007, S. 318–324, ISSN 1476-4687. doi:10.1038/nature05944. PMID 17554336.
- P. D. Tonge, A. J. Corso, C. Monetti, S. M. Hussein, M. C. Puri, I. P. Michael, M. Li, D. S. Lee, J. C. Mar, N. Cloonan, D. L. Wood, M. E. Gauthier, O. Korn, J. L. Clancy, T. Preiss, S. M. Grimmond, J. Y. Shin, J. S. Seo, C. A. Wells, I. M. Rogers, A. Nagy: Divergent reprogramming routes lead to alternative stem-cell states. In: Nature. Band 516, Nummer 7530, Dezember 2014, S. 192–197, ISSN 1476-4687. doi:10.1038/nature14047. PMID 25503232.
- S. M. Hussein, M. C. Puri, P. D. Tonge, M. Benevento, A. J. Corso, J. L. Clancy, R. Mosbergen, M. Li, D. S. Lee, N. Cloonan, D. L. Wood, J. Munoz, R. Middleton, O. Korn, H. R. Patel, C. A. White, J. Y. Shin, M. E. Gauthier, K. A. Lê Cao, J. I. Kim, J. C. Mar, N. Shakiba, W. Ritchie, J. E. Rasko, S. M. Grimmond, P. W. Zandstra, C. A. Wells, T. Preiss, J. S. Seo, A. J. Heck, I. M. Rogers, A. Nagy: Genome-wide characterization of the routes to pluripotency. In: Nature. Band 516, Nummer 7530, Dezember 2014, S. 198–206, ISSN 1476-4687. doi:10.1038/nature14046. PMID 25503233.
- I. H. Park, R. Zhao u. a.: Reprogramming of human somatic cells to pluripotency with defined factors. In: Nature. Band 451, Nummer 7175, Januar 2008, S. 141–146, ISSN 1476-4687. doi:10.1038/nature06534. PMID 18157115.
- K. Takahashi, K. Tanabe u. a.: Induction of pluripotent stem cells from adult human fibroblasts by defined factors. In: Cell. Band 131, Nummer 5, November 2007, S. 861–872, ISSN 0092-8674. doi:10.1016/j.cell.2007.11.019. PMID 18035408.
- J. Yu, M. A. Vodyanik u. a.: Induced pluripotent stem cell lines derived from human somatic cells. In: Science. Band 318, Nummer 5858, Dezember 2007, S. 1917–1920, ISSN 1095-9203. doi:10.1126/science.1151526. PMID 18029452.
- Referenzen zu Originalarbeiten in Hochedlinger, Plath (2009)
- M. Stadtfeld, M. Nagaya u. a.: Induced pluripotent stem cells generated without viral integration. In: Science. Band 322, Nummer 5903, November 2008, S. 945–949, ISSN 1095-9203. doi:10.1126/science.1162494. PMID 18818365.
- K. Okita, M. Nakagawa u. a.: Generation of mouse induced pluripotent stem cells without viral vectors. In: Science. Band 322, Nummer 5903, November 2008, S. 949–953, ISSN 1095-9203. doi:10.1126/science.1164270. PMID 18845712.
- H. Zhou, S. Wu u. a.: Generation of induced pluripotent stem cells using recombinant proteins. In: Cell stem cell. Band 4, Nummer 5, Mai 2009, S. 381–384, ISSN 1875-9777. doi:10.1016/j.stem.2009.04.005. PMID 19398399.
- unbekannt: Method of the Year 2009. In: Nature Methods. 7, 2010, S. 1–1, doi:10.1038/nmeth.f.294.
- K Hochedlinger, K Plath: Epigenetic reprogramming and induced pluripotency. Development 136, 509–523 (2009), PMID 19168672
- Lebende Mäuse aus induzierten, pluripotenten Stammzellen
- Artikel in der Asahi-Shinbun zur beschleunigten Herstellung innerhalb von 10 Tagen. http://www.asahi.com/science/update/1227/OSK201112270081.html (Memento vom 31. Dezember 2011 im Internet Archive)
- S Yamanaka: Elite and stochastic models for induced pluripotent stem cell generation. Nature 460, S. 49–52 (2009), PMID 19571877
- J Hanna et al.: Direct Reprogramming of Terminally Differentiated Mature B Lymphocytes to Pluripotency. Cell 133, S. 250–264 (2008), PMID 18423197
- D Huangfu et al.: Induction of pluripotent stem cells by defined factors is greatly improved by small-molecule compounds. Nature Biotechnology 26, S. 795–797 (2008) PMID 18568017
- J Hanna, K Saha, B Pando, J van Zon, CJ Lengner, MP Creyghton, A van Oudenaarden, R Jaenisch: Direct cell reprogramming is a stochastic process amenable to acceleration. Nature 462, 595–601 (2009)PMID 19898493
- JT Dimos et al.: Induced Pluripotent Stem Cells Generated from Patients with ALS Can Be Differentiated into Motor Neurons. Science 321, S. 1218–1221 (2008), PMID 18669821
- AD Ebert et al.: Induced pluripotent stem cells from a spinal muscular atrophy patient. Nature 457, S. 277–280, PMID 19098894
- J Hanna et al.: Treatment of Sickle Cell Anemia Mouse Model with iPS Cells Generated from Autologous Skin. Science 318, S. 1920 (2007), PMID 18063756
- M Wernig et al.: Neurons derived from reprogrammed fibroblasts functionally integrate into the fetal brain and improve symptoms of rats with Parkinson's disease. PNAS 105, S. 5856–5861 (2008), PMID 18391196
- Interview mit Rudolf Jaenisch
- Interview mit Konrad Hochedlinger
- Baker (2009), S. 964
- David Cyranoski: Stem cells: 5 things to know before jumping on the iPS bandwagon. Nature 452, 406–408 (2008), PMID 18368095
- nach Baker (2009)
- Archivlink (Memento des Originals vom 12. Juni 2009 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- David Cyranoski: Papers on ‘stress-induced’ stem cells are retracted. Nature News, 2. Juli 2014 doi:10.1038/nature.2014.15501