Octopin
D-Octopin ist ein Guanidinderivat. Es wurde aus Muskelgewebe verschiedenen wirbellosen Tieren, wie z. B. Octopus, Pecten maximus oder Sipunculus nudus isoliert, wo es ein funktionelles Analogon zur Milchsäure (Lactat) darstellt.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
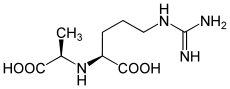 | ||||||||||
| D-Octopin | ||||||||||
| Allgemeines | ||||||||||
| Name | Octopin | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C9H18N4O4 | |||||||||
| Kurzbeschreibung |
weißer bis bräunlicher Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 246,27 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Schmelzpunkt | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Geschichte
Octopin ist das erste isolierte Opin. Es verdankt seinen Namen Octopus octopodia, aus dem es 1927 gewonnen wurde.[3]
Biosynthese
D-Octopin wird durch eine stereoselektive NADH-abhängige Octopin-Dehydrogenase (EC 1.5.1.11) aus Pyruvat und L-Arginin über eine reduktive Kondensation gebildet.[4] L-Arginin selbst wird dabei aus Phospho-L-Arginin gewonnen. Dadurch kann das bei der Glykolyse anfallende reduzierte Nikotinamidadenindinukleotid NADH reoxidiert werden, so dass NAD+ entsteht. Dies entspricht der Milchsäuregärung, bei der Pyruvat zu L-Lactat reduziert wird.
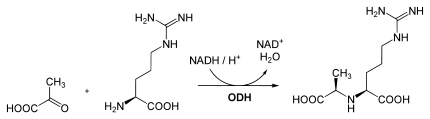
Die Reaktion ist auch umkehrbar: Aus NAD+ kann wieder NADH gebildet und D-Octopin in Pyruvat und L-Arginin gespalten werden.
Bedeutung
Tintenfische müssen sich bei Flucht oder Angriff schnell fortbewegen können, was viel Energie in Form von ATP erfordert. Jedoch kann das nötige ATP nicht aus der aeroben Atmung gewonnen werden, da Sauerstoff nicht schnell genug in die Zellen gelangen kann. Bei Tintenfischen ist für die schnelle Fortbewegung ein spezieller Muskel verantwortlich, der die Energie auf anaeroben Wege der Glykolyse durch die Bildung von D-Octopin bezieht.
Es wurde lange Zeit antizipiert, dass im Gegensatz zur Milchsäuregärung anfallendes D-Octopin als schwache Säure nicht zur Ansäuerung der Zelle beiträgt (Azidose). Dem ist entgegenzuhalten, dass D-Octopin im Gegensatz zu Lactat den intrazellulären Raum nicht verlassen kann und sich damit in größeren Mengen ansammelt.[5] Schließlich führe die biochemische Bildung von D-Octopin auch zur Azidose.[5]
Siehe auch
Einzelnachweise
- Datenblatt Octopin bei Acros, abgerufen am 26. Februar 2010.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Morizawa, K. (1927): Über die Extraktstoffe von Octopus octopodia. In: Acta Schol. Med. Kyoto 10, 285–298.
- Smits, SH. et al. (2008): A structural basis for substrate selectivity and stereoselectivity in octopine dehydrogenase from Pecten maximus. In: J Mol Biol. 381(1); 200–211; PMID 18599075; doi:10.1016/j.jmb.2008.06.003.
- Pörtner, HO. (2002): Environmental and functional limits to muscular exercise and body size in marine invertebrate athletes. In: Comp Biochem Physiol A Mol Integr Physiol. 133 (2); 303–321; PMID 12208302; doi:10.1016/S1095-6433(02)00162-9.